Estimation of Addition and Removal Processes of Nutrients from Bottom Water in the Saemangeum Salt-Water Lake by Using Mixing Model
This study has been executed to understand the additional and removal processes of nutrients in the Saemangeum Salt-water Lake, and discussed with other monthly-collected environmental parameters such as water temperature, salinity, dissolved oxygen, suspended solids, and Chl-a from 2008 to 2010. NO3-N, TP, PO4-P, and DISi showed the removal processes along with the salinity gradients at the surface water of the lake, whereas NO2-N, NH4-N, and Chl-a showed addition trend. In the bottom water all water quality parameters except NO3-N appeared addition processes indicating evidence of continuous nutrients suppliance into the bottom layer. The mixing modelling approach revealed that the biogeochemical processes in the lake consume NO3-N and consequently added NH4-N and PO4-P to the bottom water during the summer seasons. The NH4-N and PO4-P appeared strong increase at the bottom water of the river-side of the lake and strong concentration gradient difference of dissolved oxygen also appeared in the same time. DISi exhibited continuous seasonal supply from spring to summer. Internal addition of NH4-N and PO4-P in the river-side of the lake were much higher than the dike-side, while the increase of DISi showed similar level both the dike and river sides. The temporal distribution of benthic flux for DISi indicates that addition of nutrients in the bottom water was strongly affected by other sources, for example, submarine ground-water discharge (SGD) through bottom sediment.
초록
이 연구는 새만금 방조제가 조성된 이후 새만금호에서 영양염(NO3-N, NO2-N, NH4-N, TN, PO4-P, TP, DISi)의 거동을 이해하기 위해 수행되었으며, 특히 2008년~2010년까지 새만금호의 표층과 저층에서 매월 관측된 환경인자(수온, 염분, 용존산소, 부유물질, Chl-a)와 상호 비교하여 특징을 논의하였다. 표층에서 NO3-N, TP, PO4-P, DISi는 제거현상을 보였고, NO2-N, NH4-N, Chl-a는 첨가현상을 보였다. 저층에서는 NO3-N을 제외하고 모든 항목들이 첨가현상을 보였다. 따라서 NO3-N을 제외한 나머지 영양염들은 저층수에서 지속적으로 공급되고 있음을 의미한다. 혼합모델을 이용하여 저층수에서 영양염의 거동을 분석한 결과, 생지화학적 과정에 의해 NO3-N이 주로 하계에 감소되는 것으로 나타났고, NH4-N과 PO4-P는 하계에 증가되는 것으로 나타났다. 특히 PO4-P와 NH4-N의 증가는 강하구 쪽에서 더욱 뚜렷하게 나타났고, 표층과 저층 사이의 DO의 농도 차이와 강한 양의 상관성을 보였다. DISi도 저층수에서 지속적으로 공급되고 있음을 보였으나, NH4-N과 PO4-P와는 다르게 하계뿐만 아니라 춘계에도 공급되는 경향을 보였다. 또한 NH4-N과 PO4-P가 방조제 쪽보다 하구 쪽에서 더 많이 공급되는 것과는 다르게 DISi는 양쪽에서 유사하게 공급됨을 보였다. 이러한 DISi의 특징은 퇴적물로부터 분자확산에 의한 flux를 계산한 결과, 저층수에서 공급되는 영양염은 퇴적물로부터 용출되는 것 이외에 SGD 등 다른 유입기원이 있는 것을 암시한다.
Keywords:
Saemangeum saltwater lake, Nutrient, Addition, Removal, Mixing model, 새만금호, 영양염, 첨가, 제거, 혼합모델1. 서 론
육상으로부터 공급된 영양염은 하구에서 다양한 생지화학적 반응을 거쳐 해양으로 이동하게 된다. 용존무기질소(NO3-N, NO2-N, NH4-N)는 수중에서 식물플랑크톤에 의한 흡수, 질산화 작용, 탈질산화 작용 등에 의해서 영향을 받으며(Herbert[1999]), 퇴적물과의 상호 과정에 의해서도 영향을 받는다. 용존무기질소 중 NO3-N은 하구에서 주로 염분에 대해 보존적인 특징을 보이고(Lee and Yang[1997]; Yang et al.[1999]), NH4-N의 경우에는 부유입자나 유기물질과의 흡착 또는 휘발과정 등에 의해서 수중에서 감소하거나 제거된다는 보고도 있다(Gardner et al.[1991]; Hargreaves[1998]). PO4-P는 식물플랑크톤에 의한 흡수, 퇴적물로부터 용출, 부유입자로부터 탈착 과정(Fox et al.[1986]; Guillaud et al.[2000])에서 수중으로 첨가되거나 제거된다. DISi(dissolved inorganic silicon)는 식물플랑크톤에 의한 흡수(Calloway and Specht[1982]; Conley and Malone[1992]), 부유입자로부터 탈착과 흡착(Mayer and Gloss[1980]; Bowes and House[2001]), 퇴적물로부터 용출에 의해서 영향을 받는다. 한편, 최근에는 연안에서 해저 지하수를 통해 공급되는 영양염이 상대적으로 중요하다고 보고되고 있다(Hwang et al.[2005]; Burnett et al.[2007]; Kim et al.[2008]; Santos et al.[2009]).
하구에서 용존 물질들이 생지화학적 반응에 참여하지 않고 이동된다면 이들 용존 물질은 해양환경에서 보존적인 염분에 대한 1차 함수로 표현될 수 있다. 이렇게 혼합 직선(CML; conservative mixing line)상에 어떤 용존 물질이 놓여 있으면 그 물질은 보존적(conservative)이라고 하며, CML상에서 벗어나 위로 볼록하거나 아래로 오목하게 나타나면 그 물질은 비보존적(non-conservative)이라고 한다(Morris[1985]). 따라서 염분에 대해 어떤 용존 물질의 농도를 도시하여 우리는 그 시스템이 그 용존 물질에 어떤 역할을 하고 있는지 평가할 수 있다. 이러한 염분에 대한 혼합을 이용한 연구들은 대부분 염분에 대한 용존 물질의 보존적 또는 비보존적인 특성을 파악하데 더 중점을 두어 수행되고 있으며(Sholkovitz[1976]; Fisher et al.[1988]; Balls[1994]; Yang et al.[1999]; Markager et al.[2011]), 영양염의 flux를 산정하기 위한 연구(Ki[1987]; Rendell et al.[1997]), 과잉의 영양염 농도를 추정하기 위한 연구(Kim et al.[2009]) 등도 수행되고 있다.
이 연구는 새만금 방조제의 최종 끝물막이 이후 조성된 새만금호 내에서 방조제가 조성되기 이전에 비하여 영양염(특히 NH4-N, PO4-P, DISi)의 농도가 높아지고 있는 현상과 관련하여(Yang et al.[2008]; Jeong and Yang[2014]), 이들 영양염의 거동을 분석하고 이해하고자 수행되었다. 따라서 이 연구의 결과들은 새만금호의 수질 변화에 대한 이해를 돕고, 다른 하구환경에서 영양염의 거동을 분석하기 위한 하나의 수단으로서 적용할 수 있을 것이다.
2. 지역 개괄
새만금사업은 1991년 11월 16일 착공하여, 2006년 4월 방조제 끝막이 공사가 완료됨에 따라 33 km의 방조제공사가 최종 완료되었다. 새만금의 총 개발면적은 40,100 ha이며, 이 중 28,300 ha의 새로운 토지와 11,800 ha의 면적을 가진 새만금 담수호가 조성될 예정이다. 현재는 내부 방수제공사가 진행 중에 있으며, 신시배수갑문과 가력배수갑문은 연 중 상당기간 개방된 상태로 있어 해수의 유통이 자유롭게 이루어지고 있는 실정이다. 그러나 방조제의 최종 끝물막이 이전에 비하여 해수의 교환율은 44% 감소하여(Kim et al.[2007]), 조차는 방조제의 최종 끝물막이 이전에 약 6 m에서 이후 약 1 m로 감소하였다(Lie et al.[2008]). 연간 담수의 방출량은 만경강이 5.01×108~29.84×108 m3/year이고, 동진강이 4.05×108~6.99×108 m3/year이며, 만경강과 동진강의 연 방출량은 금강의 30% 정도이다(KORDI[2007]). 새만금 유역의 전체면적은 3,319 km2로 만경강 수계가 1,571 km2, 동진강 수계가 1,004 km2로 전체 유역면적의 77.5%를 차지한다. 새만금호의 서쪽은 방조제의 조성으로 인하여 서해와 분리되어 있고, 북쪽과 동쪽 그리고 남쪽은 각각 군산시, 김제시, 부안군으로 둘러싸여 반폐쇄적인 해수호수의 특성을 보인다.
3. 재료 및 방법
3.1 시료 채취
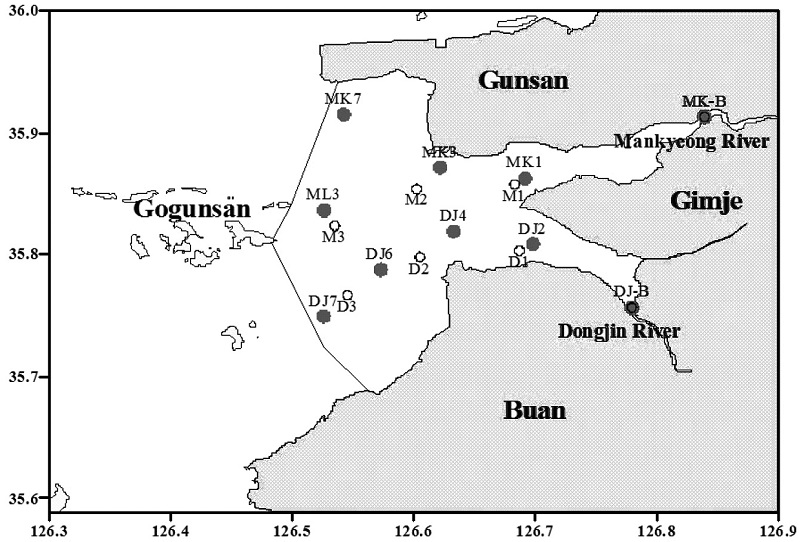
시료채취는 2008년 5월부터 2010년 10월까지 방조제 내측의 6~8개 정점의 표층수와 저층수에 대해 총27회 수행하였다(Fig. 1). 또한 담수가 유입되는 만경대교와 동진대교에서 동일시기에 표층수를 채수하였다. 2010년도에는 방조제 내측의 6개 정점에서 퇴적물 시료도 채취하였다. 각 조사시기별 정점수와 조사 당일의 유입하천(만경강 대천지점)의 유량 자료는 Table 1에 제시하였다. 새만금 방조제의 최종 끝물막이 이후 새만금호 내 조차가 1 m 이내로 감소됨(Lie et al.[2008])에 따라 시료채취는 외측해역의 조석 변화와 무관하게 수행되었다. 시료채집은 선박을 이용하여 빠르게 이동하며 표층수와 저층수를 채수하였고, 표층수는 플라스틱 재질의 양동이를 이용하여 채수하였으며, 저층수는 미리 산세척된 호스에 연동펌프를 연결하여 바닥으로부터 약 50 cm에서 저층퇴적물이 재부유되지 않도록 주의하면서 채수하였다. 채집된 시료는 1 L 폴리에틸렌병에 담아 즉시 드라이아이스 또는 얼음이 담긴 아이스박스에 보관한 후 실험실로 옮긴 다음 분석 전까지 -20 oC 이하로 동결 보관하였다. 퇴적물 시료는 Grab 채니기로 채집하여 표층퇴적물을 산세척된 지퍼팩에 담아 해수시료와 마찬가지로 실험실로 이동시켜 분석 전까지 동결 보관하였다.
3.2 분석방법
수온, 염분, 용존산소(DO; Dissolved Oxygen)는 수질다항목측정기(556MPS, YSI)를 이용하여 현장에서 직접 측정하였다. SS(Suspended Solids)는 시료 500 mL를 GF/C 여과지로 여과한 후 건조기로 105 oC에서 항량으로 건조하여 건조전과 건조후의 무게 차이로 측정하고, SS 분석과정에서 여과지를 통과한 여과수에 대하여 영양염류의 분석을 수행하였다. PO4-P는 몰리브덴산 암모니움(ammonium molybdate) 용액, 황산, 아스코르빈산(ascorbic acid), 타르타르산 안티모닐 칼륨(potassium antimonyltartrate) 용액의 혼합 시약으로 반응시킨 후 885 nm에서 정량 측정하였다(Parsons et al.[1984]). NH4-N은 페놀로 고정한 후 니트로프루시드 나트륨(sodium nitroprusside) 용액, 알칼리 용액, 차아염소산 나트륨(sodium hypochlorite) 용액, 산화제로 반응시킨 후 640 nm에서 정량 측정하였다(Solorzano[1969]). NO2-N은 술퍼닐 아미드(sulfanilamide) 용액과 나프틸에틸렌디아민이염산염(naphthylethylene diamine dihydrochloride) 용액으로 반응시킨 후 543 nm에서, NO3-N은 Cd-Cu 환원 칼럼을 통하여 NO2-N으로 환원시킨 후 아질산염과 동일한 방법으로 정량 측정하였다(Parsons et al.[1984]). DISi은 파라몰리브덴산암모니움(ammonium paramolybdate) 용액과 메톨-무수아황산나트륨(metol-anhydrous sodium sulfite) 용액, 옥살산(oxalic acid), 황산(sulfuric acid) 혼합액으로 반응시킨 후 810 nm에서 정량 측정하였다(Parsons et al.[1984]). TN(Total nitrogen)과 TP(Total phosphorus)는 여과되지 않은 시료를 알카리성 산화완충용액(NaOH + Na2S2O3 + H3BO3)을 사용하여 고압증기 멸균기에서 산화시킨 후(Hansen and Koroleff, 1999) NO3-N과 PO4-P와 동일한 방법으로 분석하였다. 엽록소-a(Chl-a)는 90% 아세톤 추출법을 사용하여 분석하였으며(Parsons et al.[1984]), 비색법에 의한 정량 측정은 분광광도계(UV-160A, 1750 SHIMADZU)를 사용하였다. 퇴적물의 공극수는 현장에서 저퍼백에 담아온 퇴적물을 아크릴 박스로 제작한 glove box에 넣고, 질소 대기상에서 원심분리 튜브에 옮긴 후 원심분리기(VS-5000N, VISION)를 이용하여 추출하였으며, PO4-P, NH4-N, DISi에 대하여 해수시료와 동일한 방법으로 분석하였다.
3.3 보존적 혼합 모델
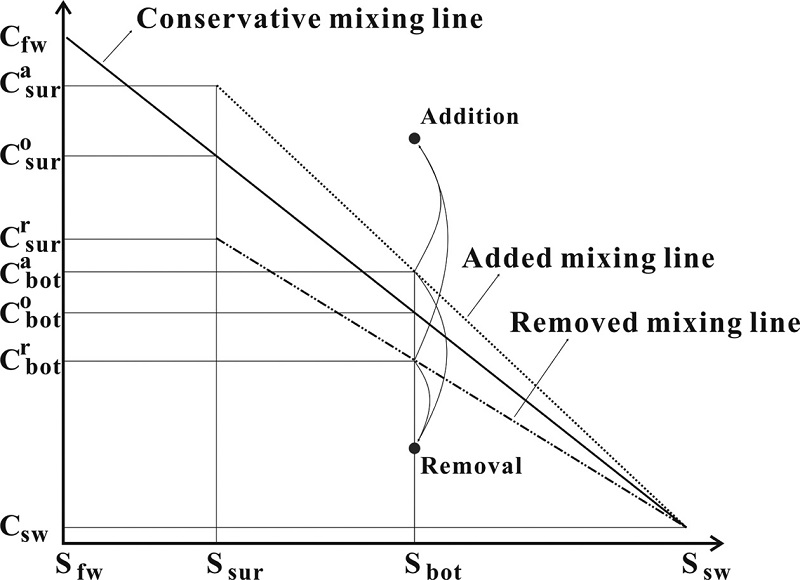
하구환경에서 육상으로부터 유입되는 담수는 외해역의 해수와 혼합되어 염분의 기울기를 형성하고, 이러한 염분의 기울기를 따라 담수 내에 포함된 고농도의 용존 물질은 점차 희석되어 감소될 것이다. 따라서 담수로부터 공급된 어떤 용존 물질이 단순한 물리적인 희석에 의해 외해역으로 이동된다면 그 용존 물질은 염분에 대한 1차 함수로 표현할 수 있다. 이러한 단순한 희석효과만을 고려한다면 동일한 염분을 갖는 어떤 지점의 표층수와 저층수의 용존 물질은 같은 농도를 나타낼 것이고, 만약 서로 다른 염분을 갖는다면 용존 물질의 농도는 염분에 대한 1차 함수의 직선상에 각각 놓여 있게 될 것이다. 그러나 하구환경에서 용존 물질은 다양한 생지화학적 과정 등을 거쳐 이동하면서 원래의 염분에 대한 보존적인 특성에서 벗어나는 경우를 종종 발견하게 된다(Lee and Yang[1997], Yang et al.[1999]). 어떤 지점에서 저층수 내 용존 물질의 농도는 표층수를 비롯한 주변지역의 해수와의 혼합과 퇴적물과의 상호작용 등에 의해서 영향을 받게 될 것이고, 이러한 과정을 거치며 저층수 내 용존 물질의 농도는 변하게 된다. 그러므로 표층수나 주변지역에서 단순한 물리적인 희석에 의해서 결정되는 저층수 내 용존 물질의 농도를 알 수 있다면, 그 이외의 생지화학적 과정 등에 의해서 공급되거나 제거된 농도를 추정할 수 있을 것이다. 단순한 희석에 의해 이동되는 저층수 내 용존 물질의 농도(Cobot)는 표층수 및 저층수의 염분값과 표층수 내 용존 물질의 농도로 추정할 수 있다(Fig. 2). 따라서 현장조사를 통해 분석된 저층수 내 어떤 용존 물질의 농도가 CML상에서 벗어나 있다면 그 용존 물질의 농도는 저층수에서 생지화학적 과정 등을 거쳐 공급 또는 제거된 최종결과로 판단할 수 있다. 그러나 Cobot를 추정하기에 앞서 만약 알고하자는 Cobot이 위치한 지점의 표층수에서 생물활동 등에 의해 용존 물질의 첨가 및 제거과정이 발생한다면, 이러한 표층수의 변동을 고려한 새로운 혼합 직선(AML; added mixing line, 또는 RML; removed mixing line)이 형성되고, Cobot는 Cabot 또는 Crbot로 변하게 될 것이다(Fig. 2).
Kim et al.[2009]은 새만금호 내에서 저층에서 과잉으로 존재하는 영양염의 농도를 추정하기 위해 혼합모델을 사용하였는데, 이들의 연구에서는 혼합 모델식(ΔCbot = Cbot - Ca,rsur (32-Sbot)/(32-Ssur))을 유도하는 과정에서 외해수의 영양염의 농도를 0으로 가정하였고, 이와 함께 외해수의 염분을 32 psu로 일정하게 설정하였다. 그러나 새만금 외측해역에서 관측된 영양염의 농도는 분명한 계절적인 변화를 보이고 있으며, 염분 또한 계절별로 변동을 보인다(MLTMA[2011]). 따라서 이러한 외해수의 특성을 고려하지 않고 Cobot, Cabot, Crbot를 계산한다면 과대 또는 과소평가될 수 있다. 따라서 이 연구에서는 Kim et al.[2009] 연구 이후 새만금호의 저층수의 영양염들의 거동을 파악하기 위해 외해수의 변동을 고려한 모델식을 유도하였고, 외해수의 염분 및 영양염의 자료는 한국해양과학기술원에서 이 연구와 동일한 달에 분석된 자료(person. comm.)를 사용하였다.
Fig. 2에서 CML의 기울기(k)는 다음과 같다.
(1)
여기에서 C는 용존 물질의 농도이고, S는 염분을 의미한다. Co는 CML상의 용존 물질의 농도이고, 아래첨자 fw, sw, sur은 담수, 외해수, 표층을 의미한다.
AML과 RML의 기울기(ka,r)는 k를 이용하거나, 주어진 표층수의 농도 및 표층수와 저층수의 염분 차이로 계산할 수 있다.
(2)
여기에서 위첨자 a,r은 첨가나 제거를 의미하며, 아래첨자 bot는 저층수를 의미한다. 식 (2)에서 Ca,rbot는 다음과 같고,
(3)
Ca,rbot가 현장에서 측정된 저층수의 농도(Cbot)와 같으면 저층수의 농도는 단순한 희석에 의해서만 영향을 받은 것이고, Ca,rbot가 현장에서 측정된 저층수의 농도보다 크거나 작다면 저층수에서 공급되었거나 제거되었음을 의미한다. 결과적으로 저층수에서 공급되었거나 제거된 용존 물질의 농도(ΔCbot)는 다음과 같이 표현된다.
(4)
여기에서 ΔCbot가 양의 값이면 공급, 음의 값이면 제거된 농도를 의미한다.
4. 결과 및 토의
4.1 조사시기별 새만금호 내 수질 변동 특성
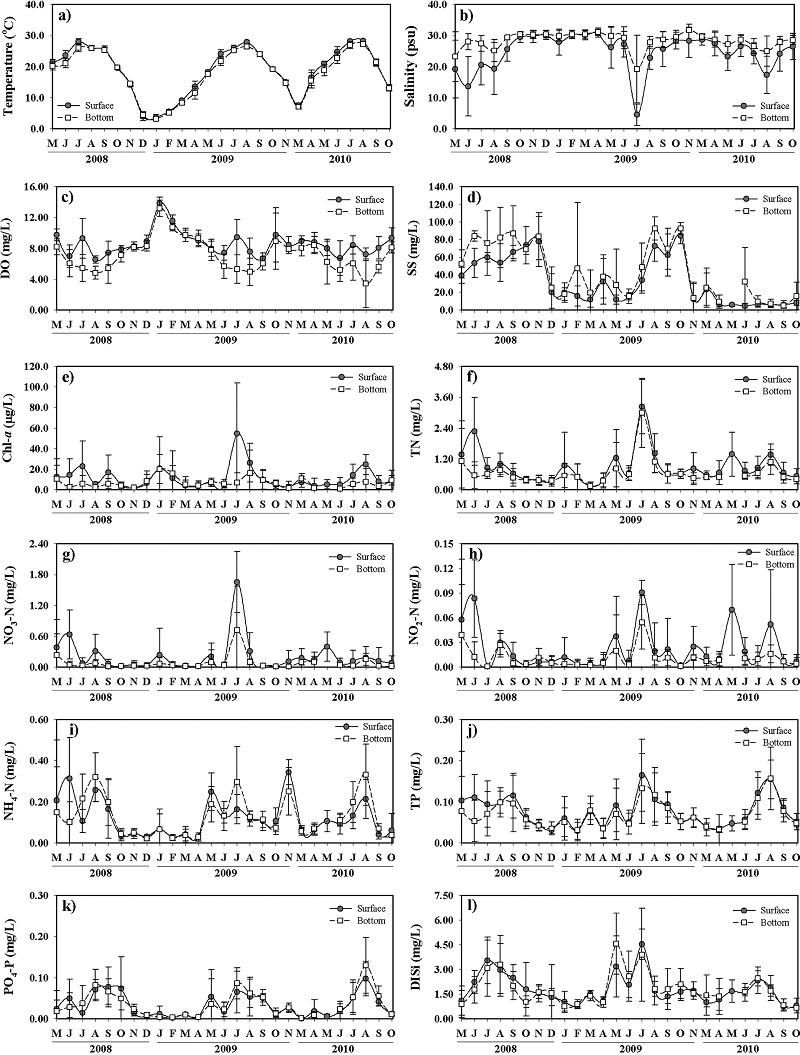
새만금호의 6~8개 정점에서 측정된 각 조사시기별 수질항목들의 범위 및 평균값은 Table 2에 제시하였고, 조사기간 동안 수질의 변화를 Fig. 3에 도시하였다.
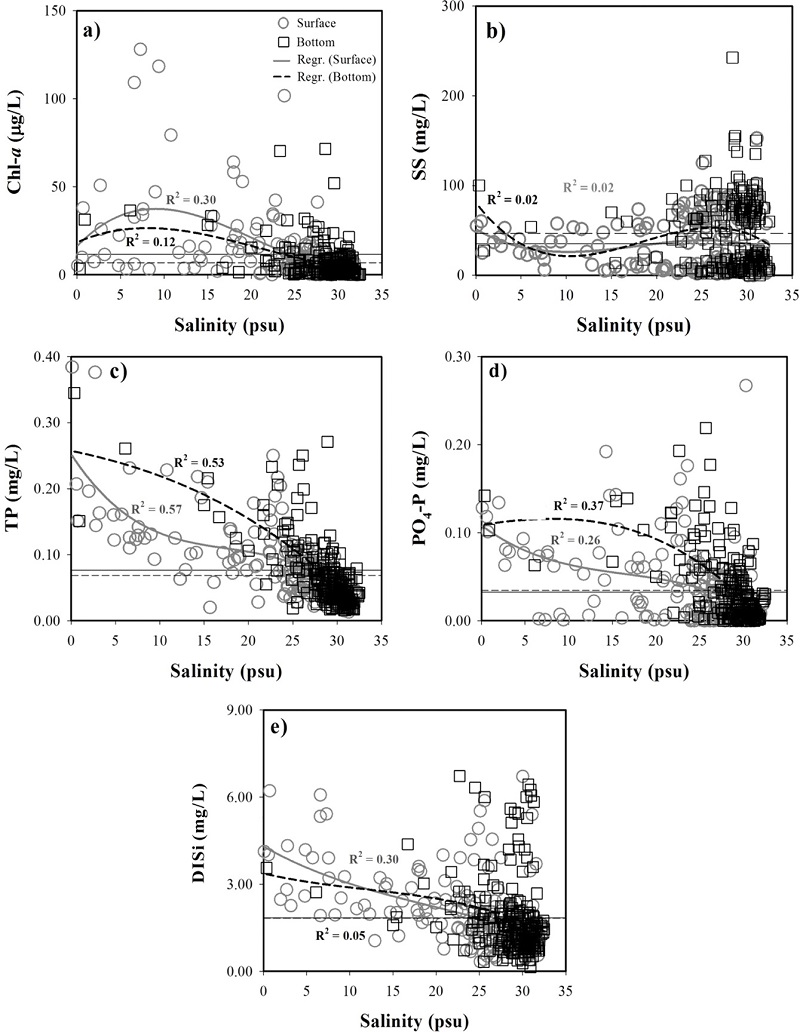
조사 기간 동안 수온은 동계에 낮고 하계에 높은 전형적인 계절 변동을 잘 나타냈다(Fig. 3a). 염분은 전체적으로 저층이 표층보다 높은 값을 보였고, 하계에 낮아지는 현상이 뚜렷하며, 또한 두 수층 간의 차이도 하계에 크게 나타났다(Fig. 3b). 특히 월평균 염분은 하천유량(만경강 대천지점)과 강한 양의 상관관계를 나타내고 있어(표층: r=-0.879, p=0.000, 저층: r=-0.678, p=0.000) 하천의 유량 변화에 의해 호 내의 염분이 강하게 영향을 받는 것으로 판단된다. DO는 동계에 높고 하계에 낮아지는 경향을 보였으며, 특히 하계에 표층과 저층 사이에 DO의 차이가 크게 나타났다(Fig. 3c). 이러한 DO의 표층과 저층 간의 차이는 두 수층의 수온의 차이(r=0.214, p=0.001)보다 염분의 차이(r=-0.530, p=0.000)와 더 강한 상관관계를 나타나고 있어 호 내의 수온 성층보다는 염분 성층으로 인해 더 영향을 받는 것으로 판단된다. SS는 전반적으로 저층이 표층보다 높은 농도를 보였고(Fig. 3d), 뚜렷한 계절변화는 나타나지 않았으며, 호 내의 수위변동과 내부공사 과정에서 발생한 먼지 및 토사의 유입으로 인해 영향을 받는 것으로 판단된다(Jeong and Yang[2014]). Chl-a는 전반적으로 표층이 저층보다 높은 농도를 보였고, 뚜렷한 계절변화는 나타나지 않았으나, 표층의 Chl-a는 염분이 감소하는 시기에 높게 나타나는 경향을 보였다(Fig. 3e). TN은 전반적으로 표층이 저층보다 높은 농도를 보였고, 염분과 강한 음의 상관관계를 나타냈다(표층: r=-0.859, p=0.000, 저층: r=-0.686, p=0.000). NO2-N과 NO3-N은 TN과 유사한 변화를 보였다. 그러나 NH4-N은 2010년에 저층이 표층보다 높은 농도를 보였고(Table 2), 특히 염분이 감소하고 저층의 DO 농도가 낮은 시기에 저층의 농도가 표층보다 높게 나타나는 현상이 뚜렷하다(Fig. 3i). TP와 PO4-P는 하계에 높은 농도를 보였으며, PO4-P는 NH4-N과 유사한 경향을 보였다. DISi도 주로 하계에 높은 농도를 보였고, 2009년과 2010년에는 저층이 표층보다 높은 농도를 보였다(Table 2, Fig. 3l).
4.2 염분에 대한 영양염의 분포 특성
2008년~2010년까지 현장조사를 통해 분석된 자료를 바탕으로 염분에 대한 각 항목들의 분포를 Fig. 4~5에 도시하였다. 질소계 영양염을 보면, TN은 표층에서는 보존적인 특성을 보였으나, 저층에서는 첨가현상을 보였다. NO2-N은 표층에서 약간 첨가현상을 보였고, 저층에서는 첨가현상이 뚜렷하게 나타났다. NO3-N은 표층과 저층에서 제거현상을 보였으나, NH4-N은 표층과 저층에서 첨가현상을 보였다. 일반적으로 자연환경에서 NO2-N의 생성은 질산화 과정과 탈질산화 과정에서 일어나는데(Herbert[1999]), 이 연구에서는 NO3-N이 표층과 저층에서 제거현상을 보임으로 NO2-N의 첨가현상은 주로 탈질산화 과정에서 발생되었을 것으로 판단된다. Chl-a는 표층과 저층에서 첨가현상을 나타내고 있어, 새만금호 내부에서 식물플랑크톤의 증식이 일어나고 있음을 알 수 있다. SS는 표층과 저층에서 저염분에서는 제거현상을 보였고, 고염분에서는 첨가현상을 보였다. SS의 이러한 특징은 상대적으로 염분이 높은 방조제 인근에서 좁은 배수갑문을 통해 해수가 유입되면서 강한 유속으로 인해 저층으로부터 퇴적물이 재부유되기 때문으로 판단된다(Yang et al.[2008]). TP는 표층에서는 제거현상을 보였으나, 저층에서는 첨가현상을 보였고, PO4-P도 TP와 동일한 현상을 나타냈다. 표층에서 TP의 제거현상은 Chl-a의 첨가현상을 고려해 보면, TP 중 PIP의 침전이 주로 발생하는 것으로 판단되며, 이러한 현상은 SS의 제거현상으로도 추정할 수 있다. PO4-P도 TP와 마찬가지로 표층에서 PO4-P의 제거현상은 Chl-a의 첨가현상과 관련되어 있을 것으로 판단된다. DISi도 PO4-P와 같이 표층에서는 제거현상을 보였고, 저층에서는 염분에 대하여 뚜렷한 분포 특성을 보이지 않지만, 많은 부분이 호 내에서 첨가되는 특징을 보였다.
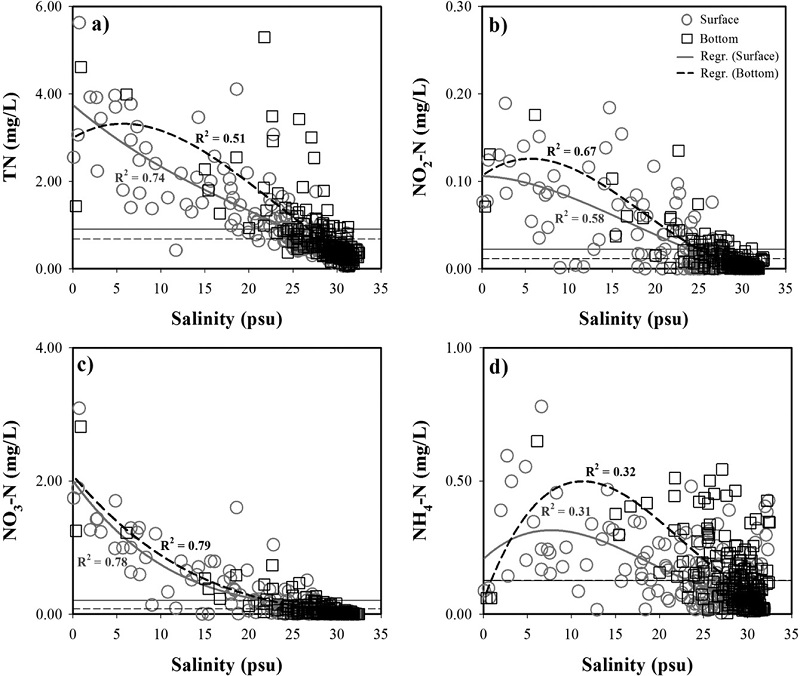
Distributions of TN, NO2-N, NO3-N, and NH4-N as a function of salinity. Horizontal solid (surface) and dash (bottom) line indicate the mean.
4.3 저층수에서 영양염의 공급과 제거
식 (4)를 이용하여 조사기간 동안 관측된 자료를 바탕으로 새만금호의 강하구 쪽(St. M1, St. D1)과 방조제 쪽(St. M3, St. D3)의 저층수 내에서 증가 또는 감소된 영양염의 농도(ΔNO3-Nbot, ΔNH4-Nbot, ΔPO4-Pbot, ΔDISibot)를 계산하였다. 외해역에 대한 염분과 영양염의 농도는 본 조사와 동일한 달에 측정된 한국해양과학기술원의 자료(person. comm.)를 사용하였다.
2008년~2010년까지 ΔNO3-Nbot는 강하구 쪽에서는 양의 값과 음의 값이 반복적으로 나타나는 경향성을 보였고, 방조제 쪽에서는 주로 하계에 상대적으로 큰 음의 값을 보였다(Fig. 6). 수중에서 NO3-N의 농도는 식물플랑크톤에 의한 흡수, 질산화(nitrification), 탈질산화(denitrification), 퇴적물로부터 용출량(benthic flux)에 의해 영향을 받는다. 질산화 과정은 NH4-N이 NO3-N으로 전환되는 과정으로 주로 퇴적물 표층의 호기성 층에서 질산화 박테리아에 의해 진행되고(Herbert[1999]), 하계에 퇴적물의 산소 소모량 증가로 인해 퇴적물 내 산소 투과깊이가 얕아지면서 질산화율은 감소하는 것으로 보고되고 있다(Hansen et al.[1981]; Macfarlane and Herbert[1984]). 반면, 탈질산화는 NO3-N이 가스형태인 질소(N2) 또는 아산화질소(N2O)로 전환되는 과정으로 주로 퇴적물 내 혐기성 환경에서 일어나며, 상층수의 NO3-N의 농도가 높고 퇴적물 내 유기물질의 농도가 높은 시기에 활발하게 진행되는 것으로 알려져 있다 (Seitzinger[1988]; Hargreaves[1998]; Pastuszak et al.[2005]). 새만금호에서 담수의 유입이 증가하는 하계에 NO3-N의 농도가 증가하고, 퇴적물의 공극수 내유기물질의 농도도 하계에 증가한다는 것을 고려한다면(Jeong and Yang[2014]), ΔNO3-Nbot의 시간에 따른 변화는 이러한 새만금호의 특성을 잘 보여주고 있는 것으로 판단된다. 결과적으로 새만금호의 저층수에서 NO3-N은 주로 봄철과 가을철에는 첨가되고, 여름철에는 제거되며, 이러한 현상은 특히 강하구 쪽에서 분명하게 나타난다. 조사 기간 동안 ΔNO3-Nbot은 강하구 쪽에서 평균 -0.04±0.12 mg/L, 방조제 쪽에서는 평균 -0.06±0.24 mg/L로 전체적으로 저층수에서 NO3-N이 제거되는 것으로 나타났다.
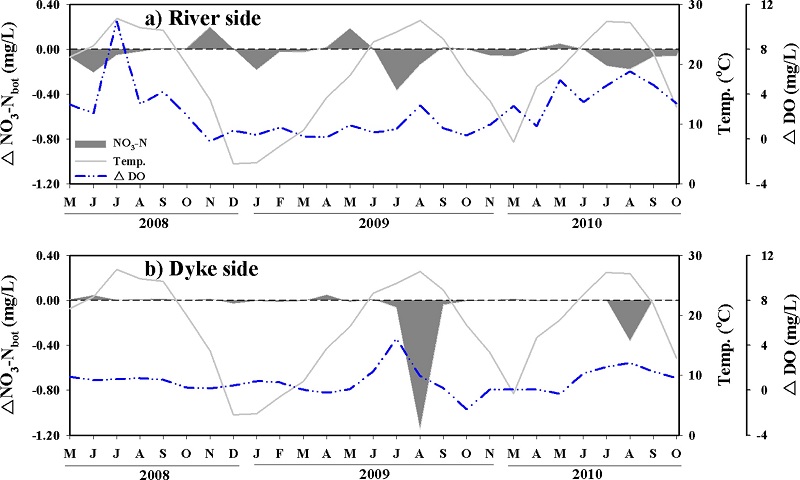
Increased and decreased concentrations of NO3-N in bottom water. ΔDO is to subtract bottom from surface.
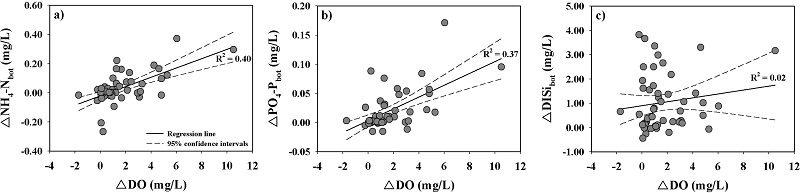
ΔNH4-Nbot은 강하구 쪽과 방조제 쪽에서 전반적으로 양의 값을 보였으며, 특히 표층수와 저층수의 용존산소의 농도 차이(ΔDO)가 크게 발생하는 하계에 높은 값을 보였다(Fig. 7). 공간적으로는 강하구 쪽이 방조제 쪽보다 더 높은 증가를 보였다. 이러한 결과들은 염분이 낮은 강하구 쪽의 표층에서 Chl-a의 첨가 현상과 입자성물질의 제거 현상 등을 고려해 볼 때 표층수에서 생산된 유기물질이 수심이 낮은 강하구 쪽에서 빠르게 저층으로 전달되어 퇴적물 내에 유기물질의 함량을 높이기 때문으로 판단된다. 이러한 benthicpelagic coupling 효과는 수층으로 빠르게 NH4-N의 방출을 일으키는 작용을 한다(Herbert[1999]). NH4-N의 생성은 유기물질의 무기화(ammonification)에 의해서 일어나기도 하며, 혐기성 환경에서는 탈질산화와는 다르게 NO3-N이 NH4-N으로 환원(nitrate ammonification)되는 과정도 보고되고 있으나(Jorgensen[1989]; Rysgaard et al.[1996]). 이 연구에서는 이러한 NH4-N의 생성과정에 대해서 자세히 밝히기는 어렵다. 결과적으로 조사 기간 동안 ΔNH4-Nbot은 강하구 쪽에서 평균 0.06±0.10 mg/L, 방조제 쪽에서는 평균 0.004±0.098 mg/L로 전체적으로 저층수에서 NH4-N이 공급되는 것으로 나타났다.
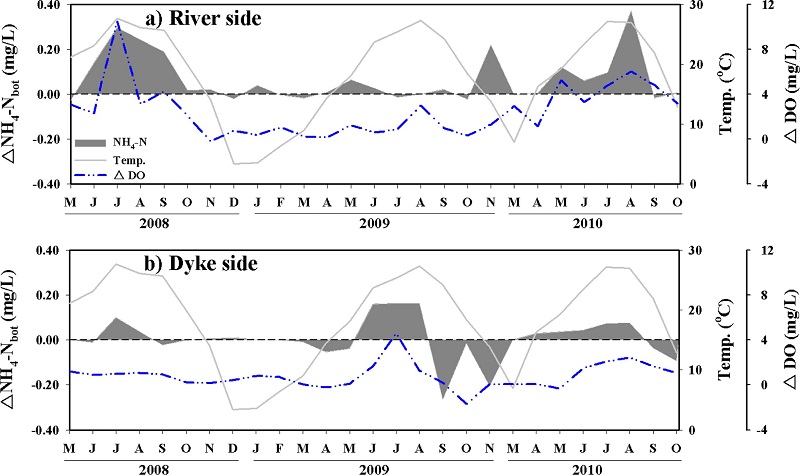
Increased and decreased concentrations of NH4-N in bottom water. ΔDO is to subtract bottom from surface.
ΔPO4-Pbot도 ΔNH4-Nbot과 유사하게 강하구 쪽과 방조제 쪽에서 전반적으로 양의 값을 보였으며, 공간적으로는 강하구 쪽이 방조제 쪽보다 더 높은 값을 보였다(Fig. 8). 2008년~2010년까지 강하구 쪽에서 ΔPO4-Pbot의 증가는 2008년과 2010년에 가장 크게 나타났으며, 2009년에는 상대적으로 낮은 증가를 보였다. 그러나 방조제 쪽에서는 2008년에 가장 낮은 증가를 보였다. 이러한 ΔPO4-Pbot 변화는 ΔDO의 변화와 유사하게 나타나고 있다. 특히 2008년과 2010년에 강하구 쪽에 위치한 정점들의 저층수에서 하계에 0.2-2.6 mg/L의 저산소 농도(hypoxia: 2.8 mg/L 미만 Diza and Rosenberg[1995]; Wu[2002])가 관측되었고, ΔPO4-Pbot의 증가도 이시기에 가장 높았다. PO4-P는 산화환원 조건에 의해서 민감하게 반응하며, 주로 퇴적물 내 철산화물과의 결합과 탈착에 의해 영향을 받는 것으로 알려져 있다(Lofgren and Bostrom[1989]; Jensen et al.[1992]; Søndergaard et al.[2003]). 따라서 저층수에서 PO4-P의 증가는 하계에 저산소 환경 등이 형성되면서, 퇴적물 내에 존재하는 철산화물이 박테리아에 의해 환원되면서 결합되어 있던 PO4-P가 저층수로 공급되는 과정에서 발생된 것으로 판단된다. 결과적으로 조사 기간 동안 ΔPO4-Pbot은 강하구 쪽에서 평균 0.03±0.04 mg/L, 방조제 쪽에서는 평균 0.01±0.02 mg/L로 전체적으로 저층수에서 PO4-P이 공급되는 것으로 나타났다.
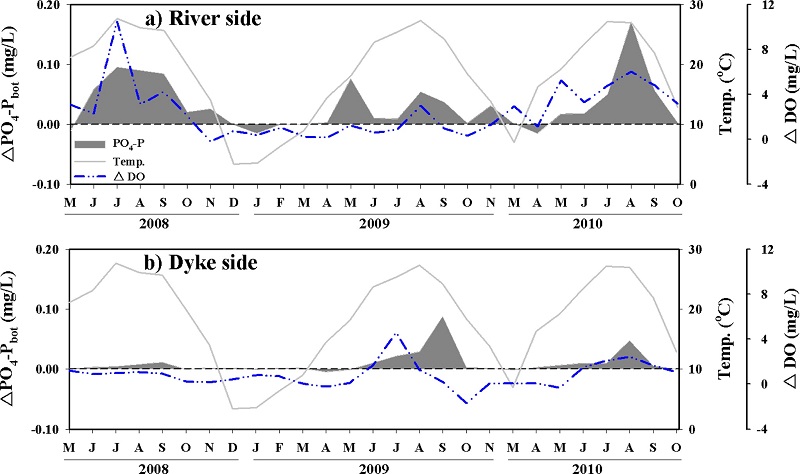
Increased and decreased concentrations of PO4-P in bottom water. ΔDO is to subtract bottom from surface.
ΔDISibot도 ΔNH4-Nbot과 ΔPO4-Pbot와 마찬가지로 하계에 높은 양의 값을 보이고 있으나, 전반적으로 양의 값을 보이는 기간이 ΔNH4-Nbot과 ΔPO4-Pbot보다 더 장기간 지속되는 것으로 나타났다(Fig. 9). 따라서 DISi의 증가는 하계뿐 만아니라 다른 계절에도 높게 이루어지고 있는 것을 알 수 있다. 또한 증가되는 ΔDISibot의 농도는 ΔNH4-Nbot과 ΔPO4-Pbot와는 다르게 강하구 쪽과 방조제 쪽이 유사하며, ΔNH4-Nbot과 ΔPO4-Pbot가 ΔDO의 변화와 양의 상관성을 갖지만, ΔDISibot는 이러한 상관성을 보이지 않았다(Fig. 10). 이러한 결과들은 저층에서 DISi의 생산이 DO의 변화 즉, 유기물질(규조류)의 분해 과정이외에 다른 추가적인 공급에 의해서 영향을 받는 것으로 판단되며, 호 내에서 전체적으로 유사하게 공급되고 있음을 의미한다. 저층에서 DISi의 증가는 첫 번째로 저층 퇴적물의 재부유에 의한 공급을 고려해 볼 수 있으며, 이러한 이유는 조사 기간 동안 SS의 농도가 표층보다 저층에서 높았고, 저층의 SS 농도는 강하구 쪽보다 방조제 쪽에서 더 높게 관측되었기 때문이다. NH4-N과 PO4-P도 저층 퇴적물로부터 재부유에 의해서 공급되었을 가능성이 있으나, DISi가 산화환원 반응에 민감하지 않다는 것을 감안하면, 상대적으로 호기성 환경인 방조제 쪽에서 NH4-N과 PO4-P 보다 DISi가 더 저층 퇴적물의 재부유에 의해서 영향을 받을 수 있을 것으로 판단된다. DISi의 다른 공급원으로는 퇴적물 내 공극수와 저층수간의 농도차에 의한 분자확산과 해저 지하수 유출(SGD; submarine groundwater discharge)에 의한 공급(Kim et al.[2005]; Beck et al.[2007]; Kim et al.[2008]) 등을 고려해 볼 수 있다. 최근 SGD에 의한 DISi의 공급은 퇴적물로부터 분자확산에 의한 용출량보다 높은 것으로 보고되고 있으며(Hwang et al.[2005]; Kim et al.[2008]), 퇴적물의 투수성에 따라 영향을 받는다(Burnett et al.[2003]). 저층수에서 증가되는 DISi가 주로 하계뿐만 아니라 용존산소가 상대적으로 풍부한 춘계에도 높게 나타나고 있으며, NH4-N과 PO4-P와는 다르게 sand 함량이 높은(61~96%) 방조제 쪽에서 높게 나타나고 있는 것은 SGD 때문인 것으로 판단된다. 결과적으로 조사 기간 동안 ΔDISibot은 강하구 쪽에서 평균 0.81±0.92 mg/L, 방조제 쪽에서는 평균 1.28±1.33 mg/L로 전체적으로 저층수에서 DISi가 공급되는 것으로 나타났다.
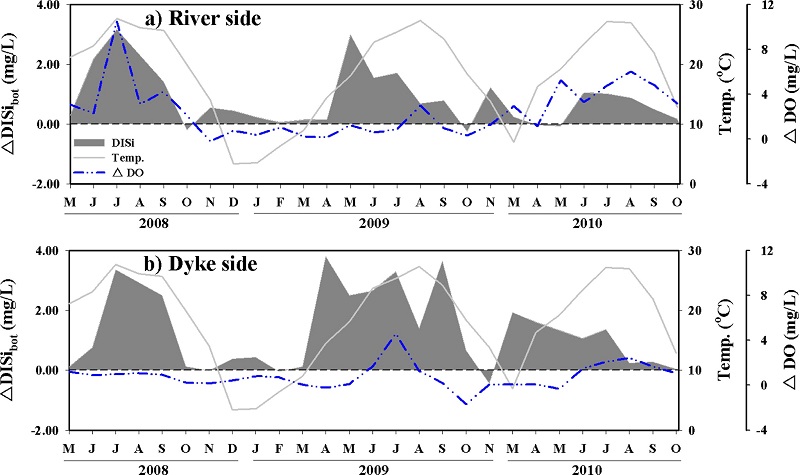
Increased and decreased concentrations of DISi in bottom water. ΔDO is to subtract bottom from surface.
4.4 퇴적물로부터 영양염의 flux
새만금호의 저층수에서 ΔNH4-Nbot 및 ΔPO4-Pbot와 ΔDISibot의 공간적인 특성이 다르게 나타나고 있어, 퇴적물로부터 이들 항목들의 flux를 공간적으로 비교하였다. 저층수와 퇴적물 경계면에서 용존 물질의 용출은 분자확산에 의해서 이루어지며, 이러한 저층 퇴적물로부터 분자확산에 의한 용존 물질의 flux(J)는 다음과 같이 Fick’s law에 의해서 계산할 수 있다.
(5)
여기에서 φ는 공극률, Dsed는 퇴적물 내 분자확산계수, ΔC/ΔZ는 저층수와 퇴적물 공극수 내 어떤 용존 물질의 농도기울기를 의미한다. φ는 퇴적물의 밀도와 함수율을 이용한 관계식(Kim and Park[1998])을 이용하여 계산하였으며, Dsed는 해수 내 분자확산계수를 이용하여 계산하였다(Schulz[2000]).
2010년 3월~10월까지 7회에 걸쳐 퇴적물로부터 분자확산에 의한 NH4-N의 flux는 강하구 쪽에서 평균 45.03 mg/m2·d로 계산되었고, 방조제 쪽에서는 평균 14.93 mg/m2·d로 나타나 강하구 쪽이 방조제 쪽보다 더 높게 나타났다. PO4-P의 flux도 강하구 쪽(평균 1.62 mg/m2·d)에서 방조제 쪽(평균 0.81 mg/m2·d)보다 더 높게 나타났다. DISi도 NH4-N와 PO4-P와 마찬가지로 강하구 쪽(평균 30.93 mg/m2·d)이 방조제 쪽(평균 21.69 mg/m2·d)보다 높게 나타났다(Table 3). 따라서 퇴적물로부터 분자확산에 의해 공급되는 영양염은 강하구 쪽이 방조제 쪽보다 상대적으로 높다는 것을 알 수 있다. 한편, ΔDISibot은 강하구 쪽과 방조제 쪽에서 유사한 값을 보이고 있어, 방조제 쪽의 저층수에서 공급되는 DISi는 퇴적물로부터 분자확산에 의해 공급되는 양 이외에 SGD 등 다른 유입원에 의해 추가적으로 공급되고 있는 것으로 판단된다. 따라서 새만금호의 수질관리를 위해서는 이러한 영양염의 다양한 유입원에 대한 정량적인 평가가 필요하다.
Acknowledgments
시료 채집과 분석에 도움을 준 군산대학교 화학해양학실 식구들의 노고에 감사드립니다.
References
-
Balls, P.W., (1994), Nutrient inputs to estuaries from nine scottish east coast rivers; influence of estuarine processes on inputs to the North Sea, Estuarine Coastal Shelf Sci, 39, p329-352.
[https://doi.org/10.1006/ecss.1994.1068]

-
Beck, A.J., Tsukamoto, Y., Tovar-Sanchez, A., Huerta-Diaz, M., Bokuniewicz, H.J., and Sanudo-Wilhelmy, S.A., (2007), Importance of geochemical transformations in determining submarine groundwater discharge-derived trace metal and nutrient fluxes, Appl. Geochem, 22, p477-490.
[https://doi.org/10.1016/j.apgeochem.2006.10.005]

-
Bowes, M.J., and House, W.A., (2001), Phosphorus and dissolved silicon dynamics in the River Swale catchment, UK: a mass-balance approach, Hydrol. Process, 15, p261-280.
[https://doi.org/10.1002/hyp.157]

-
Burnett, W.C., Bokuniewicz, H., Huettel, M., Moor, W.S., and Taniguchi, M., (2003), Groundwater and pore water inputs to the coastal zone, Biogeochemistry, 66, p3-33.
[https://doi.org/10.1023/B:BIOG.0000006066.21240.53]

-
Burnett, W.C., Wattayakorn, G., Taniguchi, M., Dulaiova, H., Sojisuporn, P., Rungsupa, S., and Ishitobi, T., (2007), Groundwater-derived nutrient inputs to the Upper Gulf of Thailand, Cont. Shelf Res, 27, p176-190.
[https://doi.org/10.1016/j.csr.2006.09.006]

-
Calloway, R.J., and Specht, D.T., (1982), Dissolved silicon in the Yaquina estuary, Oregon, Estuarine Coastal Mar. Sci, 15, p561-567.
[https://doi.org/10.1016/0272-7714(82)90007-5]

-
Conley, D.J., and Malone, T.C., (1992), Annual cycle of dissolved silicate in Chesapeake Bay: implications for the production and fate of phytoplankton biomass, Mar. Ecol. Prog. Ser, 81, p121-128.
[https://doi.org/10.3354/meps081121]

- Diaz, J.R., and Rosenberg, R., (1995), Marine benthic hypoxia: a review of its ecological effects and the behavioral responses of benthic macrofauna, Oceanogr. Mar. Biol. Annu. Rev, 33, p245-303.
-
Fisher, T.R., Harding, L.W., Stanley, D.W., and Ward, L.G., (1988), Phytoplankton, nutrients, and turbidity in the Chesapeake, Delaware, and Hudson estuaries, Estuarine Coastal Shelf Sci, 27, p61-93.
[https://doi.org/10.1016/0272-7714(88)90032-7]

-
Fox, L.E., Sager, S.L., and Wofsy, S.C., (1986), The chemical control of soluble phosphorus in the Amazon estuary, Geochim. Cosmochim. Acta, 50, p783-794.
[https://doi.org/10.1016/0016-7037(86)90354-6]

-
Gardner, W.S., Seitzinger, S.P., and Malczyk, J.M., (1991), The effects of sea salts on the forms of nitrogen released from estuarine and freshwater sediments: does ion pairing affect ammonium flux?, Estuaries, 14, p157-166.
[https://doi.org/10.2307/1351689]

-
Guillaud, J.-F., Andrieux, F., and Menesguen, A., (2000), Biogeochemical modelling in the Bay of Seine (France): an improvement by introducing phosphorus in nutrient cycles, J. Mar. Syst, 25, p369-386.
[https://doi.org/10.1016/S0924-7963(00)00028-2]

- Hansen, H.P., and Koroleff, F., (1999), Determination of Nutrient, In: Methods of Seawater Analysis. edited by K. Grasshoff, K. Kremling and M. Ehrhardt, Wiley-VCH, New York, p159-228.
-
Hansen, J.I., Henriksen, K., and Blackburn, T.H., (1981), Seasonal distribution of nitrifying bacteria and rates of nitrification in coastal marine sediments, Microb. Ecol, 7, p297-304.
[https://doi.org/10.1007/BF02341424]

- Hargreaves, J.A., (1998), Nitrogen biogeochemistry of aquaculture ponds 1, Auaculture, 166, p181-212.
-
Herbert, R.A., (1999), Nitrogen cycling in coastal marine ecosystems, FEMS Microbiol. Rev, 23, p563-590.
[https://doi.org/10.1111/j.1574-6976.1999.tb00414.x]

-
Hwang, D.W., Kim, G., Lee, Y.W., and Yang, H.S., (2005), Estimating submarine inputs of groundwater and nutrients to a coastal bay using radium isotopes, Mar. Chem, 96, p61-71.
[https://doi.org/10.1016/j.marchem.2004.11.002]

-
Jensen, H.S., Kristensen, P., Jeppesen, E., and Skytthe, A., (1992), Iron:phosphorus ratio in surface sediment as an indicator of phosphorus release from aerobic sediments in shallow lakes, Hydrobiologia, 235-236, p731-743.
[https://doi.org/10.1007/BF00026261]

- Jeong, Y.H., and Yang, J.S., (2014), The long-term variations of water qualities in the Saemangeum salt-water lake after the seadike construction, J. Kor., Soc., Mar., Environ. Ener., submitted.
- Jorgensen, K.S., (1989), Annual pattern of denitrification and nitrate ammonification in an estuarine sediment, Appl. Environ. Microbiol, 55, p1841-1847.
- Ki, J.H., (1987), The study of Nutrients Cycling in the Keum River Estuary, MS thesis, Seoul National University, p125.
- Kim, D.-H., and Park, C.-K., (1998), Estimation of nutrients released from sediments of Deukryang Bay, J. of Korean Env. Sci. Soc, 7, p425-431.
-
Kim, G., Ryu, J.W., and Hwang, D.W., (2008), Radium tracing of submarine groundwater discharge (SGD) and associated nutrient fluxes in a highly-permeable bed coastal zone, Korea, Mar. Chem, 109, p307-317.
[https://doi.org/10.1016/j.marchem.2007.07.002]

-
Kim, G., Ryu, J.W., Yang, H.S., and Yun, S.T., (2005), Submarine groundwater discharge (SGD) into the Yellow Sea revealed by 228Ra and 226Ra isotopes: Implications for global silicate fluxes, Earth Planet. Sci. Lett, 237, p156-166.
[https://doi.org/10.1016/j.epsl.2005.06.011]

- Kim, H., Lee, H., Choi, J.H., and Park, S.S., (2007), A modeling study for change of tidal zone and flushing rate by the construction of sea dike, J. of KSEE, 29, p1106-1113.
-
Kim, S.-H., Kim, K., Lee, M., Jeong, H.-J., Kim, W.-J., Park, J.-G., and Yang, J.S., (2009), Enhanced benthic nutrient flux during monsoon periods in a coastal lake formed by tideland reclamation, Estuar. Coast, 32, p1165-1175.
[https://doi.org/10.1007/s12237-009-9217-1]

- KORDI(Korea Ocean Research and Development Institute), (2007), Integrated Preservation Study on the Marine Environments in the Saemangeum Area(1st Year of 2nd phase, 2007) - Water Quality Monitoring, p321.
- Lee, S.H., and Yang, J.S., (1997), 500-days continuous observation of nutrients, chlorophyll, suspended solid and salinity in the Keum Estuary, Korea, The Sea, J. Korean Soc. Oceanogr, 2, p1-7.
-
Lie, H.-J., Cho, C.-H., Lee, S., and Kim, E.-S., (2008), Changes in marine environment by a large coastal development of the Saemangeum reclamation project in Korea, Ocean and Polar Res, 30, p475-484.
[https://doi.org/10.4217/OPR.2008.30.4.475]

-
Löfgren, S., and Boström, B., (1989), Interstitial water concentrations of phosphorus, iron and manganese in a shallow, eutrophic Swedish lake-implications for phosphorus cycling, Wat. Res, 23, p1115-1125.
[https://doi.org/10.1016/0043-1354(89)90155-3]

-
Macfarlane, G.T., and Herbert, R.A., (1984), Effect of oxygen tension, salinity, temperature an organic matter concentrations on the growth and nitrifying activity of an estuarine strain of Nitrosomonas, FEMS Microbiol. Lett, 23, p2301-2308.
[https://doi.org/10.1016/0378-1097(84)90082-X]

-
Markager, S., Stedmon, C.A., and Sødergaard, M., (2011), Seasonal dynamics and conservative mixing of dissolved organic matter in the temperate eutrophic estuary Horsens Fjord, Estuarine Coastal Shelf Sci, 92, p376-388.
[https://doi.org/10.1016/j.ecss.2011.01.014]

-
Mayer, L.M., and Gloss, S.P., (1980), Buffering of silica and phosphate in a turbid river, Limnol. Oceanogr, 25, p12-22.
[https://doi.org/10.4319/lo.1980.25.1.0012]

- MLTMA (Ministry of Land, Transport and Maritime Affairs), (2011), Saemangeum Coastal System Research for Marine Environmental Conservation, p893.
- Morris, A.W., (1985), Estuarine chemistry and general survey strategy, In: Practical estuarine chemistry, edited by P.C. Head, Cambridge University Press, p1-60.
- Parsons, T.R., Maita, Y., and Lalli, C.M., (1984), A Manual of Chemical and Biological Methods for Seawater Analysis, Pergamon Press, p173.
-
Pastuszak, M., Witek, Z., Nagel, K., Wielgat, M., and Grelowski, A., (2005), Role of the Oder estuary (southern Baltic) in transformation of the riverine nutrient loads, J. Mar. Syst, 57, p30-54.
[https://doi.org/10.1016/j.jmarsys.2005.04.005]

-
Rendell, A.R., Horrobin, T.M., Jickells, T.D., Edmunds, H.M., Brown, J., and Malcolm, S.J., (1997), Nutrient cycling in the Great Ouse Estuary and its impact on nutrient fluxes to the Wash, England, Estuarine, Coastal Shelf Sci, 45, p653-668.
[https://doi.org/10.1006/ecss.1996.0226]

-
Rysgaard, S., Risgaard-Petersen, N., and Sloth, N.P., (1996), Nitrification, denitrification, and nitrate ammonification in sediments of two coastal lagoons in Southern France, Hydrobiologia, 329, p133-141.
[https://doi.org/10.1007/BF00034553]

-
Santos, I.R., Burnett, W.C., Dittmar, T., Suryaputra, I.G.N.A., and Chanton, J., (2009), Tidal pumping drives nutrient and dissolved organic matter dynamics in a Gulf of Mexico subterranean estuary, Geochim. Cosmochim. Acta, 73, p1325-1339.
[https://doi.org/10.1016/j.gca.2008.11.029]

-
Schulz, H.D., (2000), Quantification of early diagenesis: Dissolved constituents in marine pore water, In: Schulz, H.D. and M. Zabel (eds.), Marine geochemistry, Springer, Berlin, p85-128.
[https://doi.org/10.1007/978-3-662-04242-7_3]

-
Seitzinger, S.P., (1988), Denitrification in freshwater and coastal marine ecosystems: Ecological and geochemical significance, Limnol. Oceanogr, 33, p702-724.
[https://doi.org/10.4319/lo.1988.33.4_part_2.0702]

-
Sholkovitz, E.R., (1976), Flocculation of dissolved organic and inorganic matter during the mixing of river water and seawater, Geochim. Cosmochim. Acta, 40, p831-845.
[https://doi.org/10.1016/0016-7037(76)90035-1]

- Solórzano, L., (1969), Determination of ammonia in natural waters by the phenolhypochlorite method, Limnol. Oceanogr, 14, p799-801.
-
Søetersen, M., Jensen, J.P., and Jeppesen, E., (2003), Role of sediment and internal loading of phosphorus in shallow lakes, Hydrobiologia, 506-509, p135-145.
[https://doi.org/10.1023/B:HYDR.0000008611.12704.dd]

-
Wu, R.S.S., (2002), Hypoxia: from molecular responses to ecosystem responses, Mar. Pollut. Bull, 45, p35-45.
[https://doi.org/10.1016/S0025-326X(02)00061-9]

- Yang, J.S., Jeong, J.Y., Heo, J.T., Lee, S.H., and Choi, J.Y., (1999), Chemical mass balance of materials in the Keum River Estuary 1. Seasonal distribution of nutrients, The Sea, J. Korean Soc. Oceanogr, 4, p71-79.
- Yang, J.S., Jeong, Y.H., Ji, K.H., Kim, H.S., Choi, J.H., and Kim, W.J., (2008), The early-stage changes of water qualities after the Saemangeum sea-dike construction, J. Kor. Soc. Mar. Environ. Eng, 11, p199-213.