굴(Crassostrea gigas)의 패각운동을 이용한 유해적조생물의 조기탐지모니터링 연구
초록
굴(Crassostrea gigas)의 패각운동(SVMs)을 이용하여 유해적조생물의 조기탐지 가능여부를 고찰하였다. 연안해역에서 광범위하게 적조를 발생시키는 4종의 유해적조생물에 대하여 SVMs는 소형의 홀소자 센서(Hall element sensor)를 이용하여 측정하였다. 규조류 Skeletonema costatum에 대한 굴의 SVMs는 세포밀도 증가와 함께 활발해져 500 cells mL-1 에서 14.3 ± 8.2 times hr-1를 5,000 cells mL-1에서 22.0 ± 11.7 times hr-1로 보였다. 와편모조류 Prorocentrum cordatum에 대해서는 낮은 세포밀도에서 급격한 굴의 SVMs가 관찰되어 50 cells mL-1에서 13.6 ± 1.4 times hr-1이 관찰되었다. 와편모조류 Heterocapsa circularisquama에 대해서도 낮은 세포밀도에서 굴의 급격한 SVMs가 관찰되어 20 cells mL-1에서 16.9 ± 7.2 times hr-1를 보였고, 세포밀도가 증가할수록 SVMs는 안정되었다. 와편모조류 Cochlodinium polykrikoides에 대해서는 100 cells mL-1에서 굴의 SVMs가 7.9 ± 4.8 times hr-1, 1000 cells mL-1에서 11.5 ± 4.7 times hr-1로 변화하고 있지만, 유의적인 관련성이 확인되지는 않았다. 이러한 결과 굴의 SVMs가 유해적조생물 종에 따라 다른 특성을 보였다. 이매패류의 독화 및 대량패사를 발생시키는 종에 대해서는 유해적조생물의 조기감지를 통해 수산피해 등을 저감할 수 있는 모니터링이 가능할 것으로 판단되지만, 어류독성을 보이는 C. polykrikoides에 대한 조기탐지 모니터링은 어려울 것으로 판단되었다.
Abstract
This study investigated the possibility of a bio-monitoring on the harmful red tide organisms using the shell valve movement (SVMs) of Bivalvia, Pacific oysters (Crassostrea gigas), an important domestic aquaculture organism. The SVMs measuring by using the Hall element sensor. SVMs measurements in filtered seawater to compare SVMs showed an average of 7.4 ± 1.7 times hr-1. In Skeletonema costatum, the number of SVMs became active at 14.3 ± 8.2 times hr-1 from 500 cells mL-1, however it decreased again at 22.0 ± 11.7 times hr-1 from 5,000 cells mL-1. When Pacific oysters were exposed to Prorocentrum cordatum, the number of SVMs increased at 13.6 ± 1.4 times hr-1 from the low cell density of 50 cells mL-1 with their characteristic patterns. In Heterocapsa circularisquama, SVMs were observed 16.9 ± 7.2 times hr-1 at relatively low cell density of less than 20 cells mL-1. In Cochlodinium polykrikoides, SVMs were a rapid change as 7.9 ± 4.8 times hr-1 and 11.5 ± 4.7 times hr-1 at the cell densities of 100 and 1,000 cells mL-1, respectively. These results suggested that the SVMs of Pacific oysters are different depending on species of harmful red tide organisms. These results from the species, shellfish poisons and mass mortality by harmful agal blooms such as P. cordatum and H. circularisquema was available bio-monitoring for early detection, it is expected that the fisheries damage will be reduced. But the species to produce ichthyotoxin such as C. polykrikoides will be difficult to early detection.
Keywords:
Bio-monitoring, Shell valve movements, Pacific oyster, Crassostrea gigas, Hall element sensor, Harmful red tide organisms, Diatom, Dinoflagellates키워드:
생물모니터링, SVMs 패각운동, 굴, 굴, 홀소자 센서, 유해적조생물, 규조, 와편모조류1. 서 론
연안해역의 유해적조발생은 인간 활동의 역사기록과 함께 관찰된 자연현상으로 수권생태계에 다양한 영향을 주고 있을 뿐만 아니라, 해양생물 및 수산생물에 막대한 피해를 동반하여 커다란 사회문제로 발전되어 있다(Yoon[2010]; Anderson et al.[2012]). 때문에 유해적조생물의 거동 및 조기탐지에 따른 예보 등은 범지구적인 관심사로서 발생해역의 물리"E화학적 환경인자 분석 및 원인생물의 지속적인 거동의 모니터링, 인공위성 및 항공촬영에 기반을 둔 해양관측 및 수치모델에 의존하는 바가 크다(Yoon[2010]). 그러나 최근 유해적조생물에 민감한 반응을 보이는 검지소자를 이용하는 바이오모니터링 연구가 활발하게 진행되고 있다(Nagai et al.[2006]; Bae et al.[2012]). 즉 검지소자에 의한 모니터링에서는 생물의 생리적 요인과 외부 환경변화에 민감하게 반응(Gerhardt[2007]; Davies et al.[2012])하는 행동관찰의 변화를 지속적으로 측정할 수 있게 된다(Bae et al.[2012]). 이와 같은 생물모니터링 방법은 민감도가 높고, 보다 정확하게 생물행동을 관찰할 수 있다는 장점으로 기존의 물리"E화학적 모니터링 방법에 비해 높은 효율성을 나타낸다(Oh et al.[2013]; Kim and Yoon[2017]).
굴은 한국 양식수산생물 생산량의 14%로, 패류에서는 전복 다음으로 생산량이 높고, 국내 패류생산량의 25%를 차지한다(KOSTAT[2017]). 또한 굴과 같은 저서생물인 이매패류는 이동성이 거의 없는 무척추동물로서 저서환경에 수동적으로 반응하고 있어 해역의 환경지표생물로 적합하기도 하다(Jeng et al.[2000]; Moroishi et al.[2009]). 특히 이매패류는 생체의 내부변화와 외부의 환경변화에 대한 반응을 패각의 개폐활동인 패각운동(SVMs: shell valve movements)으로 표현되는 것이 오래 전부터 알려져 왔다(Manley and Davenport[1979]; Kramer et al.[1989]).
이러한 이매패류의 SVMs는 처음에 생물의 건강도 판단에 응용(Fuji and Toda[1991])되었지만, SVMs가 생체 및 외부 환경변화에 대한 방어반응으로 인지되면서(Rajagopal et al.[1997]), 환경변화를 탐지하는 다양한 바이오모니터링 방법으로 사용되었다(Nagai et al.[2006]; Basti et al.[2009]; Jeon et al.[2016]; Moon et al.[2017]). 즉 이매패류의 SVMs는 호흡, 배설, 심박수, 먹이활동, 생물학적 리듬 등의 내부적 요인과 외부의 환경자극 그리고 포식자로부터의 회피 등에 따라 변화한다(Rao[1954]; Langton[1977]). 특히 최근에는 유해플랑크톤 등 먹이생물의 종에 따른 SVMs 변화(Basti et al.[2009]; Bougrier et al.[2003]; Damien et al.[2009])를 이용하여 유해적조의 조기탐지에 유용하게 활용할 수 있다는 것이 보고되어(Nagai et al.[2006]; Kim and Yoon[2017]), 양식어장 등의 유해적조예보에도 다양하게 이용되고 있다. 하지만 국내에서는 유해적조생물을 대상으로 한 연구결과는 매우 제한적이다(Kim and Yoon[2017]).
따라서 이 연구에서는 굴의 SVMs을 이용하여 연안 및 내만해역에서 발생하여 막대한 수산피해를 발생시키는 유해적조생물의 조기출현탐지 가능성에 대한 생물모니터링을 평가하였다.
2. 재료 및 방법
조기탐지모니터링에 사용한 유해적조생물은 규조류 Skeletonema costatum을 포함한 와편모조류 Prorocentrum cordatum, Heterocapsa circularisquama 및 Cochlodinium polykrikoides등 4종을 대상으로 하였다. 규조 S. costatum은 연안 및 내만의 식물플랑크톤 군집을 구성하는 주요종으로 국내는 물론 범지구적으로 부영양화 해역의 대표적 우점종이며, 최근 분류학적으로 수 개의 분류군으로 구분되는 등 많은 토론이 진행되는 종이다(Chen et al.[2007]; Yamada[2013])). 그리고 P. cordatum은 온대 및 아열대의 하구해역에서 범지구적으로 적조를 발생시키는 종으로(Heil et al.[2005]), 국내에서는 남해 및 시화호 등에서 대량 발생한다(NFRDI[2017]). H. circularisquama는 적조발생으로 굴이나 진주조개 등 이매패류 양식장에 막대한 피해를 동반하여 사회적 문제를 발생시키는 종이다(Matsuyama[1999]; Basti et al.[2011]). 그리고 C. polykrikoides는 열대 및 아열대해역을 중심으로 적조를 발생시키고 있지만 국내에서는 1995년 이후 여름에서 가을에 발생하는 적조의 대명사로 불리며 막대한 수산피해를 동반하는 종이다(Yoon[2010]; Matsuoka et al.[2010]). 또한 C. polykoides는 최근 분류학적 재검토에 의해 Margalefidinium polykrikoides로 학명이 변경되었지만, 여기에서는 이미 잘 알려져 있는 기존의 학명을 그대로 사용하였다(Gomez et al.[2017]).
실험에 사용한 유해적조생물종 중 Cochlodinium polykrikoides는 국립수산과학원 남해연구소에서 대량 배양(5,000 cells mL-1)한 배양주를 분양받아 실험에 제공하였고, 기타 종은 한국해양과학기술원 해양시료도서관에서 분양받은 배양주를 실험실에서 최종적으로 20L의 Nalgene 용기에 f/2 medium 배지(Guillard, 1975)를 이용하여, 수온 20 oC, 염분 30.0 psu, 명암주기(L:D)는 12h:12h, 광조건 약 100 μmol m-2 s-1의 조건에서 대수성장기까지 배양하여 실험에 제공하였다.
패각운동(SVMs)에 제공한 굴은 남해의 통영과 여수 돌산도 굴 양식장에서 월동한 2년생 각굴을 이용하였다. 제공된 굴의 각장, 각고 및 각폭은 각각 93.0 ± 6.4 mm, 27.7 ± 7.1 mm, 및 53.8 ± 8.7 mm의 범위였으며, 중량은 71.7 ± 24.6 g으로 크기에는 변화가 없었지만, 무게에서 산지에 따른 개체사이에 다소의 차이를 보였다.
선별된 굴은 굴 수하식 양식 표준 지침서(MIFAFF and NFRDI[2012])에서 권장하는 Isochrysis galbana를 하루 2회 먹이생물로 제공하였으며, 먹이섭이에 따른 SVMs의 요인을 제거하기 위하여 실험 전 3일간은 절식시킨 다음 실험에 제공하였다.
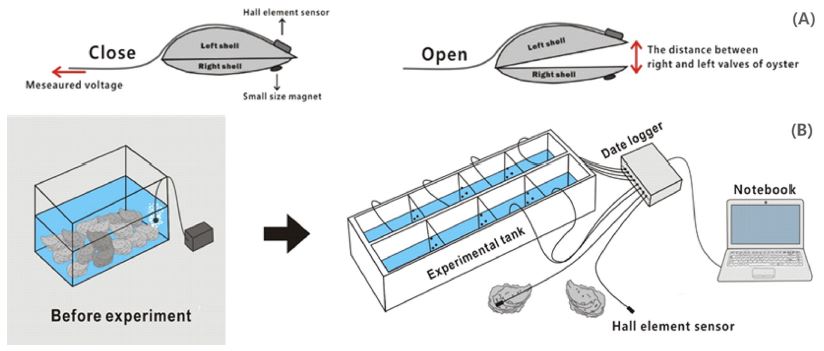
SVMs 측정은 소형 자력전기장치(Nagai et al.[2006])인 소형 홀소자(Allegro MicroSystems LLC., A1369EUA-24-T)와 SVMs 측정장치(Oceantech Co., OT-SVML-001)를 사용하였다(Fig. 1). 홀소자 센서는 무게 약 2 g, 감도 15~1,000 mV로 0.5~2.0초 간격으로 외부의 자기장 변화에 따른 센서 출력전압의 변화를 이용하여 SVMs를 연속 측정한다. 즉 굴의 왼쪽 각에 홀소자 센서를, 오른쪽 각에 자석을 붙여, 홀소자 센서와 자석사이의 거리에 따라 변화하는 출력 전압을 이용하여 SVMs를 측정하였다. 이 때 굴이 패각을 닫으면 전압이 감소하게 되고, 열면 전압이 증가하게 된다(Fig. 1A).
실험은 외부자극에 대한 스트레스 및 굴 개체 사이의 간섭을 최소화 할 수 있는 특수 제작된 수조에서 개체별 독립공간을 확보하여 진행하였다(Fig. 1B). 그리고 1회의 노출실험에 동일한 세포밀도 조건에서 8개체의 굴을 동시에 측정하도록 8개 채널의 센서를 준비하였다. 즉 8개 굴 개체 각각에 부착된 센서는 패각의 움직임에 따른 출력전압은 직접 노트북에 저장되며, 굴의 SVMs는 기록된 자료를 이용하여 분석하였다. 그리고 유해적조생물의 세포밀도의 변화는 수조의 굴에 유해적조생물 종별 세포밀도를 주입시켜 각각 1시간 폭로시켜 실험하였다. 1시간 반응실험 후, 실험수조 내에 남아있는 세포밀도를 재차 계수한 후, 보다 높은 밀도의 세포밀도로 조절하여 같은 폭로 실험을 실시한다. 이와 같은 과정을 실험대상 세포밀도가 0, 20, 50, 70, 100, 300, 500, 700, 1,000, 5,000 cells/mL의 단계별로 1시간씩 연속 폭로실험하고, 최종 세포밀도까지 실험한 다음 여과해수로 교체하여 회복기 실험을 4시간동안 계속하였다. 실내실험의 빛 조건은 모두 명 조건에서 실시하며, 수온은 16.7 ± 0.44 oC로 실험기간 동안 동일한 조건을 유지하였다. 수온이 20 oC 이상이 되면 굴은 산란하며 급격히 체력이 감소하기 때문에, 모든 실험은 20 oC 이하의 수온에서 진행하였다(Kim et al.[2009]).
3. 결 과
3.1 굴의 기준 SVMs
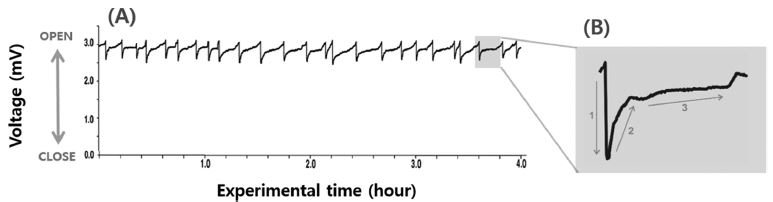
굴의 생체 내부 및 외부 환경자극에 대한 최적의 조건을 도출시켜 이매패의 SVMs 측정과 결과를 객관화 시키는 것은 단순하지 않기 때문에 여기서는 각 실험구의 결과를 비교하기 위한 기준으로는 절식 후 여과해수에서 수 시간 동안 연속 측정된 굴의 SVMs 결과를 사용하였다(Fig. 2). 굴의 기준 SVMs은 개체에 따라 차이는 있지만 약 5~10 times hr-1 범위에서 평균 7 times hr-1 전후의 SVMs 횟수를 보였고(Fig. 2A), SVMs 패턴은 패각이 닫히는 것 (폐각)은 매우 빠르게 진행되는 것에 반해, 패각이 열리는 것(개각)은 천천히 진행되어, 패각이 열린 상태가 일정시간 유지되었다(Fig. 2B). 또한 굴은 SVMs에서 천천히 개각 할 때 배설이 관찰되었다.
3.2 유해적조생물에 대한 SVMs 변화
규조류 Skeletonema costatum의 세포밀도 변화에 따른 굴의 SVMs는 낮은 세포밀도에서는 변화 폭이 낮았지만, 세포밀도가 증가함에 따라 SVMs도 활발해져, 500 cells mL-1의 세포밀도에서 14.3 ± 8.21 times hr-1, 1,000 cells mL-1에서는 22.0 ± 11.70 times hr-1로 SVMs가 급격히 증가하였다(Fig. 3A & Fig. 4A). 또한 와편모조류에 비해 실험종료 이후 회복시간이 긴 특징을 보였다(Fig. 3A).
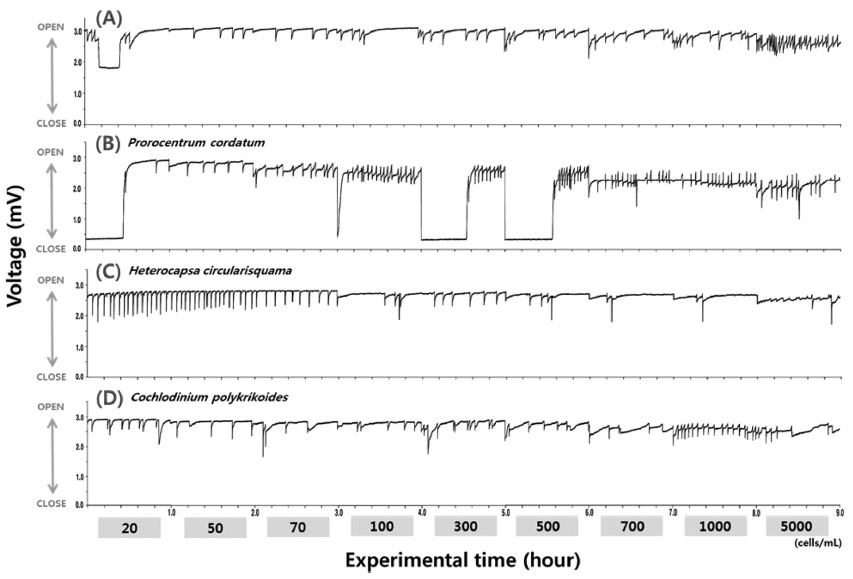
Changes of SVMs patterns of Pacific oyster on the cell density fluctuations of harmful algal species (A : Skeletonema costatum (diatom), B : Prorocentrum cordatum (dinoflagellate), C : Heterocapsa circularisquama (dinoflagellate), D : Cochlodinium polykrikoides (dinoflagellate)).
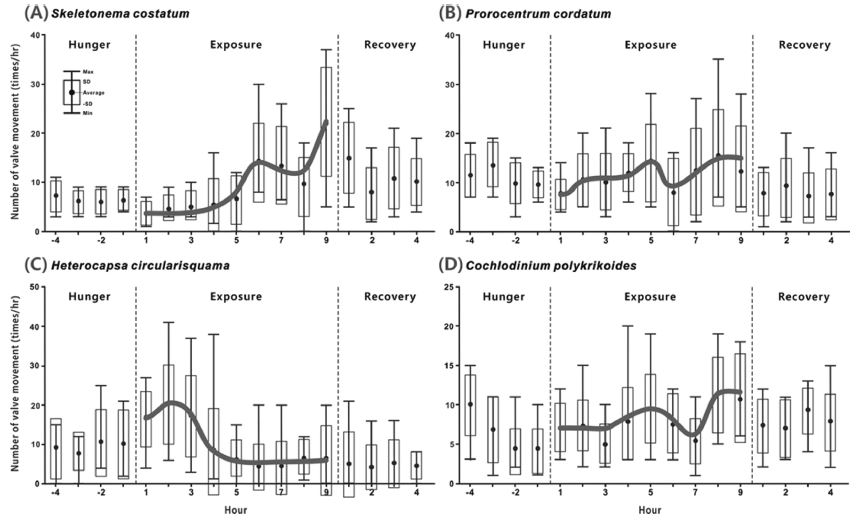
Changes of SVMs times of Pacific oyster on the cell density fluctuations of harmful algal species (A : Skeletonema costatum, B : Prorocentrum cordatum, C : Heterocapsa circularisquama, D : Cochlodinium polykrikoides).
유해 와편모조류 Prorocentrum cordatum은 낮은 세포밀도인 50 cells mL-1에서 13.6 ± 1.36 times hr-1의 SVMs으로 정상범위를 넘었다. 이후 SVMs 횟수는 완만하게 증가하였다(Fig. 3B & Fig. 4B). 유해 와편모조류 Heterocapsa circularisquama에 대한 굴의 SVMs는 낮은 세포밀도인 20 cells mL-1에서 16.9 ± 7.18 times hr-1의 격렬한 SVMs를 나타내었고, 점차 세포밀도가 증가함에 따라 SVMs는 안정화 되었고, 노출실험에서는 빠르게 회복되는 결과를 보였다(Fig. 3C & Fig. 4C). 그리고 유해의 무각 와편모조류 Cochlodinium polykrikoides의 세포밀도 변화에 대한 굴의 SVMs의 변화는 P. cordatum이나 H. circularisquama과는 달리 굴의 3/8정도 개체에서 50 cells mL-1 이하의 낮은 세포밀도의 C. polykrikoides농도에서 패각이 닫힌 상태가 유지되는 것이 관찰되었다. 또한 100 cells mL-1의 세포밀도에서 7.9 ± 4.79 times hr-1로 SVMs가 1차 증가하고, 1,000 cells mL-1의 세포밀도에서 11.5 ± 4.74 times hr-1로 재차 SVMs가 증가하였다(Fig. 3D & Fig. 4D).
4. 고 찰
담수에서 독성물질 탐지를 위해 사용하기 시작한 이매패류 SVMs를 이용한 바이오모니터링(Borcherding[1992])은 현재 담수 및 해양을 포함하는 수권에서 다양한 환경인자의 미세변화를 탐지하는 방법으로 이용 된다(Borcherding[2006]; Nagai et al.[2006]; Liao et al.[2009]; Tran et al.[2010]; Moon et al.[2017]). 구체적으로 프랑스에서는 굴 양식장의 패류독화 원인종의 출현감시를 위해(Tran et al.[2010]), 일본은 진주조개양식장의 대량폐사를 발생시키는 유해적조 원인종인 Heterocapsa circularisquama의 조기 출현를 탐지(Nagai et al.[2006])에, 독일 및 대만 등에서는 수권의 유해물질 탐지를 위한 방법(Borcherding[2006]; Liao et al.[2009]; Jou et al.[2013])으로 사용되고 있다. 그리고 국내에서도 이상 수온이나 염분의 변화(Oh et al.[2013]; Moon et al.[2017]) 및 해저 빈산소 및 황화수소의 발생(Jeon et al.[2016])과 같은 환경인자의 변화탐지 및 유독적조생물의 조기출현 탐지 기능성(Kim and Yoon [2017]) 등에 응용되고 있다.
SVMs의 측정 대상 이매패류도 패각이 매끄럽고, 센서 부착이 쉬운 담치류(Kramer el al.[1989]; Fujii and Toda[1991]; Borcherding[1992]; Rajagopal et al.[1997])를 시작으로 진주조개(Nagai et al.[2006]), 바지락(Basti et al.[2009]), 가리비(Coquereau et al.[2016]), 재첩(Liao et al.[2009]) 등 다양하지만, 전 세계에서 식용가치가 높은 굴(Damien et al.[2009]; Oh et al.[2013])을 대상으로 최근 많은 연구가 진행되고 있다. 특히 굴의 SVMs에서 개각이 폐각보다 느리게 나타나는 이 연구의 결과는 진주조개(Pinctada fucata martensii) 및 바지락((Ruditapes philippinarum)의 실험결과와 차이를 나타내었다(Nagai et al.[2006]).
이 연구에서 유해적조생물에 대한 굴의 SVMs는 규조류에 대해서는 세포밀도 증가에 따라 SVMs도 활발해지는 경향을 보였지만, 유해 와편모조류에 대해서는 종에 따라 다소 차이는 있지만 낮은 세포밀도에서 급격하게 SVMs가 높아지는 것이 관찰되었지만, 이후 세포밀도의 증가에 따라 SVMs는 안정화되는 것이 관찰되었다. 이러한 결과는 굴의 먹이활동이라는 내적요인에 따라 SVMs의 차이를 나타내었다(Langton[1977]; Damien et al.[2009]). 즉 규조류 Skeletonema costatum의 낮은 세포밀도에 대해서 굴은 낮은 먹이농도로 특이적 SVMs를 보이지 않지만, 세포밀도 증가에 따라 섭식활동에 따른 급격한 SVMs의 결과 노출 실험 이후에도 쉽게 원래의 상태로 회복이 늦어지는 것으로 판단되었다.
그러나 패류에 영향을 주는 유해 와편모조류에 대해서는 낮은 세포밀도에 대해서도 급격한 SVMs를 보이는 것은 굴 내부의 방어행동으로 보고되었다(Langton[1977]; Damien et al.[2009]). 일례로 Prorocentrum cordatum은 프랑스에서 패류독성 원인종(Heil et al.[2005])으로 알려지고 있으며, 이 종을 진주담치 먹이생물로 제공되었을 때, 진주담치는 유독조류에 노출되는 것을 방어하는 면역반응으로 위와 장에 다량의 혈구가 이동된다. 혈구는 소화관에서 독성세포를 포집하여 체내로 섭취된 P. cordatum이 다른 세포 내의 조직과 접촉하는 것을 최소화 시키는 것이 알려지고 있다(Galimany et al.[2008]). 바지락을 이용한 실험에서도 유사한 결과가 도출되고 있으며(Hegaret and Wikfors[2005]), 기타의 여러 종의 이매패류에서도 유사한 영향이 보고되는 내용(Galimany et al.[2008])은 이 논문의 결과를 지지하는 것이라 할 수 있다.
Heterocapsa circularisquama에 대해서도 P. cordatum과 유사한 결과를 보였다. H. circularisquama는 적조발생으로 이매패류에 치명적 피해를 발생시키는 원인생물로, 이 종에 노출된 이매패류는 아가미에서 점액물질이 축척되어 여과활동이 감소하는 것이 알려지고 있으며, 이는 직접적으로 패류의 아가미를 손상시키는 영향도 있지만, H. circularisquama 세포표면의 불안정한 활성물질이 패류의 스트레스를 발생시키는 것으로 추정되었다(Matsuyama et al.[1997]). 즉 H. circularisquama의 낮은 세포밀도에서 굴의 SVMs가 활발한 것은 유해조류가 생산하는 활성물질을 감지하여 민감한 반응을 하는 것으로 판단된다(Jonsson et al.[2009]). 이와 같은 결과는 진주조개(Nagai et al., 2006)나 바지락(Basti et al., 2009)에 대한 H. circularisquama의 실험에서도 유사한 결과가 보고된다. 즉 굴은 H. circularisquama를 낮은 세포밀도로 섭식하게 되면, SVMs에 의해 외부로 배출 가능하지만, 섭식된 세포밀도가 증가하면 외부 배출이 불가능하여 SVMs를 통한 여과활동을 거부하여 폐각상태를 유지하는 것(Nagai et al.[2006])도 이러한 결과를 지지하고 있다.
국내의 대표적인 여름 및 가을 유해 와편모조류 Cochlodinium polykrikoides에 대한 굴의 SVMs 패턴은 위의 P. cordatum이나 H. circularisquama와는 다른 결과를 보였다. C. polykrikoides의 낮은 세포밀도에서 일부 개체는 패각을 닫거나 매우 낮은 SVMs를 나타내었다. 그러나 세포밀도의 증가에 따라서도 국립수산과학원에서 적조주의보가 내려지는 100 cells mL-1와 적조경보가 발효되는 1,000 cells mL-1의 세포밀도에서 1차 및 2차의 SVMs의 증가가 관찰되지만(NFRDI[2007]), 기준이 되는 굴의 SVMs와 유의적인 차이가 관찰되지는 않았다. 이러한 이유로서 생각할 수 있는 것은 P. cordatum 및 H. circularisquama는 대발생으로 패류독화 및 패류의 대량폐사를 발생시키는 종인 것에 반해 C. polykrikoides은 주로 어류에 피해를 발생시키고 있어(Griffith and Gobler[2016]), 종에 따라 굴의 SVMs가 다른 특이성을 나타내는 것으로 판단되었다.
굴의 SVMs를 이용하여 조기 유해적조탐지 가능성을 고찰한 결과와편모조류 Prorocentrum cordatum 및 Heterocapsa circularisquama와 같이 패류독화 및 패류의 대량폐사 등 직접적인 영향을 주는 원인생물에 대해서는 이매패류의 SVMs를 이용하여 낮은 농도에서부터 조기탐지가 가능한 것으로 판단되었다(Kim and Yoon[2017]). 그러나 Cochlodinium polykrikoides와 같이 주로 어류독성을 나타내는 유해적조생물에 대해서는 조기탐지 가능성이 낮은 것으로 판단되어, 보다 심도 있는 검토가 필요한 것으로 판단되었다. 실제 진주조개 양식으로 유명한 일본 이세만에서 적조발생으로 진주조개에 막대한 피해를 발생시키는 유해적조생물인 H. circularisquama의 조기출현 탐색을 위한 진주조개의 SVMs 측정기기를 현장에 설치하여 적조발생에 대한 피해경감에 크게 기여하는 것으로 알려지고 있다(Nagai et al.[2006]; Honjo [personal community]).
Acknowledgments
이 논문은 해양수산부(해양과학기술진흥원) 지원 2015년도 미래해양산업기술개발사업인 “이매패류 바이오센서를 활용한 연안환경모니터링 시스템 개발” (과제번호 20150129) 지원으로 수행되었다.
References
- Anderson, D.M., Cembella, A.D., and Hallegraeff, G.M., (2012), Progress in understanding harmful algal blooms (HABs): Paradigm shifts and new technologies for research, monitoring and management, Ann. Rev. Mar. Sci, 4, p143-176.
-
Bae, M.J., Kim, J.S., and Park, Y.S., (2012), Evaluation of changes in effluent quality from industrial complexes on the Korean nationwide scale using a self-organizing map, Int’l J. Environ. Res. Public Health, 9, p1182-1200.
[https://doi.org/10.3390/ijerph9041182]

-
Basti, L., Nagai, K., Shimasaki, Y., Oshima, Y., Honjo, T., and Segawa, S., (2009), Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behavior of the Manila clam Ruditapes philippinarum, Aquacul, 291, p41-47.
[https://doi.org/10.1016/j.aquaculture.2009.02.029]

- Borcherding, J., (1992), Another early warning system for the detection of toxic discharges in the aquatic environment based on valve movements of the freshwater mussel Dreissena polymorpha, Limnol. Aktuell, 4, p127-146.
-
Borcherding, J., (2006), Ten years of practical experience with the Dreissena-Monitor, a biological early warning system for continuous water quality monitoring, Hydrobiol, 556, p417-426.
[https://doi.org/10.1007/s10750-005-1203-4]

-
Bougrier, S., Lassus, P., Bardouil, M., Masselin, P., and Truquet, P., (2003), Paralytic shellfish poison accumulation yield and feeding time activity in the Pacific oyster (Crassostrea gigas) and king scallop (Pecten maximus), Aqua. Liv. Res, 16, p347-352.
[https://doi.org/10.1016/s0990-7440(03)00080-9]

- Chen, G.F., Wang, G.C., Zhang, B.Y., and Fan, X.L., (2007), Morphological and phylogenetic analysis of Skeletonema costatumlike diatoms (Bacillariophyta) from the China Sea, Eur. J. Phycol, 42, p163-175.
-
Coquereau, L., Jolivet, A., Hégaret, H., Chauvaud, L., (2016), Short-term behavioural responses of the Great scallop Pecten maximus exposed to the toxic alga Alexandrium minutum measured by accelerometry and passive acoustics, Publ. Lib. Sci, 11, e0160935.
[https://doi.org/10.1371/journal.pone.0160935]

- Damien, T., Hansy, H., Philippe, S., Pierre, C., and Jean-Charles, M., (2009), Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum, Aquacul, 298, p338-345.
- Davies, N.B., Krebs, J.R., and West, S.A., (2012), An Introduction to Behavioural Ecology (4rd eds), Wiley Blackwell Scientific, London.
- Fujii, T., and Toda, S., (1991), Open and close shell-movement of the mussel, Mytilus edulis L. under natural conditions, Bull. Nat’l Res. Inst. Aquacul, 20, p33-40.
-
Galimany, E., Sunila, I., Hegaret, H., Ramon, M., and Wikfors, G.H., (2008), Pathology and immune response of the blue mussel (Mytilus edulis L.) after an exposure to the harmful dinoflagellate Prorocentrum minimum, Harmful Algae, 7, p630-638.
[https://doi.org/10.1016/j.hal.2008.01.001]

-
Gerhardt, A., (2007), Aquatic behavioral ecotoxicology-prospects and limitations, Human Ecol. Risk Assess. - Int’l J, 13, p481-491.
[https://doi.org/10.1080/10807030701340839]

- Gómez, F., Richlen, M.L., and Anderson, D.M., (2017), Molecular characterization and morphology of Cochlodinium strangulatum, the type species of Cochlodinium, and Margalefidinium gen. nov. for C. polykrikoides and allied species (Gymnodiniales, Dinophyceae), Harmful Algae, 63, p32-44.
-
Griffith, G.W., and Gobler, C.J., (2016), Temperature controls the toxicity of the ichthyotoxic dinoflagellate Cochlodinium polykrikoides, Mar. Ecol. Prog. Ser, 545, p63-76.
[https://doi.org/10.3354/meps11590]

-
Guillard, R.R.L., (1975), Culture of phytoplankton for feeding marine invertebrates, In; Smith, W.L., and M .H. Chanley (Eds.), Culture of Marine Invertebrate Animals, Plenum Press, New York, p26-60.
[https://doi.org/10.1007/978-1-4615-8714-9_3]

- Heil, C.A., Glibert, P.M., and Fan, C., (2005), Prorocentrum minimum (Pavillard) Schiller A review of a harmful algal bloom species of growing worldwide importance, Harmful Algae, 4, p449-470.
- Hegaret, H., and Wikfors, G.H., (2005), Time-dependent changes in hemocytes of eastern oysters, Crassostrea virginica, and northern bay scallops, Argopecten irradians irradians, exposed to a cultured strain of Prorocentrum minimum, Harmful Algae, 4, p187-199.
-
Jeng, M.S., Jeng, W.L., Hung, T.C., Yeh, C.Y., Tseng, R.J., Meng, P.J., and Han, B.C., (2000), Mussel watch: a review of Cu and other metals in various marine organisms in Taiwan, 1991~98, Environ. Poll, 110, p207-215.
[https://doi.org/10.1016/s0269-7491(99)00304-8]

- Jeon, J.Y., Moon, S.Y., and Oh, S.J., (2016), Bio-monitoring system using shell valve movements of Pacific oyster (Crassostrea gigas). 1. Detecting abnormal shell valve movements under hypoxia water using hall element sensor, J. Mar. Life Sci, 1, p25-30.
-
Jonsson, P.R., Pavia, H., and Toth, G., (2009), Formation of harmful algal blooms cannot be explained by allelopathic interactions, Proceed. Nat’l Acad. Sci. USA, 106, p11177-11182.
[https://doi.org/10.1073/pnas.0900964106]

-
Jou, L.J., Lin, S.C., Chen, B.C., Chen, W.Y., and Liao, C.M., (2013), Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system, Comp. Electro, Agricult, 90, p106-118.
[https://doi.org/10.1016/j.compag.2012.09.008]

-
Kim, C.W., Kim, E.O., Jeong, H.D., Jung, C.G., Park, M.W., and Son, S.G., (2009), Variation of body composition and survival rate according to spawning of Pacific Oyster, (Crassostrea gigas) in Gamak Bay, Korean J. Fish. Aqua. Sci, 42, p481-486.
[https://doi.org/10.5657/kfas.2009.42.5.481]

- Kim, Y.J., and Yoon, Y.H., (2017), A studies on the bio-monitoring using shell valve movements (SVMs) of Pacific Oyster Crassostrea gigas for toxic dinoflagellates, Genus Alexandrium, J. Korea Acad. -Indust. Coop. Soc, 18(11), p778-784.
- KOSTAT (Statistics Korea), http://kostat.go.kr (2017).
- Kramer, K.J.M., Jenner, H.A., and Zwart, D.D., (1989), The valve movement response of mussels: a tool in biological monitoring, Hydrobiol, 188, p433-443.
-
Langton, R.W., (1977), Digestive rhythms in the mussel Mytilus edulis, Mar. Biol, 41, p53-58.
[https://doi.org/10.1007/bf00390581]

-
Liao, C.M., Jau, S.F., Lin, C.M., Jou, L.J., Liu, C.W., Liao, V.H.C., and Chang, F.J., (2009), Valve movement response of the freshwater clam Corbicula fluminea following exposure to waterborne arsenic, Ecotoxicol.
[https://doi.org/10.1007/s10646-009-0314-5]

-
Manley, A.R., and Davenport, J., (1979), Behavioural responses of some marine bivalves to heightened seawater copper concentrations, Bull. Environ. Contam. Toxicol, 22, p739-744.
[https://doi.org/10.1007/bf02027017]

-
Matsuoka, K., Mizuno, A., Iwataki, M., Takano, Y., Yamatogi, T., Yoon, Y.H., and Lee, J.B., (2010), Seed populations of a harmful unarmored dinoglagellate Cochlodinium polykrikoides Margalef in the East China Sea, Harmful Algae, 9, p548-556.
[https://doi.org/10.1016/j.hal.2010.04.003]

- Matsuyama, Y., (1999), Harmful Effect of Dinoflagellate Heterocapsa circularisquama on Shellfish Aquaculture in Japan, JARQ, 33, p283-293.
-
Matsuyama, Y., Uchida, T., and Honjo, T., (1997), Toxic effects of thedinoflagellate Heterocapsa circularisquama on clearance rate of theblue mussel Mytilus galloprovincialis, Mar. Ecol, 146, p73-80.
[https://doi.org/10.3354/meps146073]

- MIFAFF(Ministry for Food, Agriculture, Forestry and Fisheries) and NFRDI(National Fisheries Research and Development Institute), (2012), Standard Manual of Pacific Oyster Hanging Culture (11-1541370-000323-01).
-
Moon, S.Y., Kim, D.H., Yoon, Y.H., and Oh, S.J., (2017), A study on bio-monitoring systems using shell valve movements of Pacific oysters (Crassostrea gigas) in response to abnormal high water temperature, Korean Soc. Mar. Environ. Safety, 23, p91-97.
[https://doi.org/10.7837/kosomes.2017.23.1.091]

- Moroishi, J., Kang, I.J., Nagafuchi, K., Honjo, T., Shimasaki, Y., and Oshima, Y., (2009), Biological monitoring to detect both water pollution and water quality recovery based on valve movements of freshwater bivalves (Corbicula japonica), J. Fac. Agr., Kyushu Univ, 54, p413-420.
-
Nagai, K., Honjo, T., Go, J., Yamashita, H., and Oh, S.J., (2006), Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a hall element sensor, Aquacul, 255, p395-401.
[https://doi.org/10.1016/j.aquaculture.2005.12.018]

- NFRDI (National Fisheries Research and Development Institute), http://www.nifs.go.kr/red/main.red (2017).
-
Oh, S.J., Lee, J.H., and Kim, S.Y., (2013), Bio-monitoring system using shell valve movements of Pacific oyster (Crassostrea gigas) - I. Detecting abnormal shell valve movements under low salinity using a hall element sensor, J. Korean Soc. Mar. Environ. Energy, 16, p138-142.
[https://doi.org/10.7846/jkosmee.2013.16.2.138]

- Rajagopal, S., Velde, G.V.D., and Jenner, H.A., (1997), Shell valve movement response of dark false mussel, Mytilopsis leucophaeta, to chlorination, Water Res, 31, p3187-3190.
- Rao, K.P., (1954), Tidal rhythmicity of rate of water propulsion in Mytilus californianus and its modifiability by transplantation, Biol. Bull, 43, p283-293.
-
Tran, D., Haberkorn, H., Soudant, P., Ciret, P., and Massabuau, J.C., (2010), Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum, Aquacul, 298, p338-345.
[https://doi.org/10.1016/j.aquaculture.2009.10.030]

- Yamada, M., (2013), Recent studies on biodiversity and eco-physiological characteristics of the genus Skeletonema (Bacillariophyceae), Bull. Plankton Soc. Japan, 60, p18-28.
- Yoon, Y.H., (2010), Red Tides–The uprising from the sea-, Gipmundang, Seoul.