금강 하구역 조하대 연성저질 대형저서동물 군집 공간분포의 단기간 변화
초록
금강 하구역 종합관리시스템 개발에 필요한 저서생태계 기초정보 및 관리방향을 제시하기 위해 대형저서동물 공간분포특성의 단기간 변화를 연구하였다. 금강하구둑에서 외해에 이르는 공간에서 26개 정점을 대상으로 2014-2015년에 걸쳐 2개월 간격으로 4회를 조사하였다. 퇴적환경은 전반적으로 일정한 상태를 유지하고 있으나 하구둑 인근 및 수로 해역에서의 물리적 교란은 저서동물 군집에 불안한 환경을 제공하고 있다. 대형저서동물은 총 211종이 출현하였고, 평균서식밀도는 941 ind./m2, 평균생물량은 153.1 g/m2이며 다모류, 갑각류, 연체동물이 우점하여 다른 하구역과 대체로 비슷한 수준을 보였다. 우점종인 고리버들갯지렁이(Heteromastus filiformis)는 전체 정점의 90.4%에서 출현하였으며 이 중 30종 이상 출현하는 경우가 45%를 차지하여 저서생물 다양성에 긍정적인 영향을 주었다. 집괴분석으로 분류된 4개의 정점군은 하구둑에서 외해로 가면서 물리적 교란, 염분구배, 퇴적상에 따라 공간적으로 뚜렷하게 구분되었고, 이러한 정점군 구분은 조사기간동안 일정하게 유지되었다. 하구둑 인근 및 군장항 수로 해역의 저서군집은 물리적 교란에 의한 영향을 받고 있어 안정적인 하구생태계의 복원을 위해서는 자연스러운 해수유통과 개발사업의 최소화가 요구된다.
Abstract
This study aims to provide the scientific information of benthic ecosystem and management strategy in order to develop an integrative management system of Geum River estuary (GRE). Sediment and macrofauna samples were collected four times during 2014-2015 at 24 stations, located from tidal barrage, sea route, and outer estuary. Sedimentary environment was stable and consistent during the study period except near tidal barrage and sea route disturbing macrozoobenthic community. A total of 211 species occurred with mean density of 941 ind./m2 and mean biomass of 153.1 g/m2, mainly composed of polychaetes, crustaceans and mollusks. The most density dominant species, Heteromastus filiformis, appeared at 90.4% of total stations of which 45% showed a high species diversity over 30 species, affecting positively benthic biodiversity. Four station groups, clearly classified by cluster analysis, positioned consistently during the study period from tidal barrage to outer estuary according to physical disturbance, salinity, and sediment facies. Natural seawater circulation and development mitigation would be necessary to restore estuarine ecosystems disturbed by tidal barrage and sea route.
Keywords:
Geum River estuary, Macrozoobenthic community, Salinity, Estuary management키워드:
금강하구, 대형저서동물 군집, 염분, 하구관리1. 서 론
하구생태계는 지구상에서 가장 가치가 높은 생태계로 영양염순환, 생물다양성, 관광 등의 생태계서비스를 제공한다(Barbier et al.[2011]; Costanza et al.[1997]). 하구역의 생태적 가치가 높은 이유는 육상, 하천, 해양의 전이지대에 위치하여 이들을 기능적으로 연결하는 중요한 역할을 하기 때문이다(Gray[2002]). 이러한 하구역은 염분변화가 심하며 때로는 예측이 불가능한 물리화학적 특성을 보인다(Costanza et al.[1993]; Day et al.[1989]; McLusky[1993]). 대부분의 하구역은 이러한 자연적 스트레스에 더해 인간활동에 의해 영향을 받고 있으며 매립, 하수, 항만, 준설 등이 하구역 환경의 손실을 초래하는 주요 원인이다(Davidson et al.[1991]; Gray[1997]). 하구생태계는 물리화학적 스트레스로 인해 생물다양성이 낮은 것으로 알려져 있지만 기수환경에 적응하여 서식하는 다양한 생물들이 분포하며, 하천 기원의 유기물이 직접 공급되기 때문에 생산력이 아주 높은 생태계이다(Feebarani et al.[2016]; Maurer and Vargas[1984]). 하구생태계가 제공하는 중요한 생태적 기능으로 어류나 새우의 산란지, 바다새의 월동지와 먹이 공급, 바다와 강을 오가는 회유성 어류의 이동통로 등이 알려져 있다(Day et al.[1989]; McLusky[1989]; Odum[1983]).
대형저서무척추동물은 이차생산자와 먹이공급원으로서 하구생태계의 탄소순환과 먹이사슬에서 중요한 역할을 한다. 또한 퇴적물에 서식하는 특성 때문에 환경변화와 오염을 지시하는 생물학적 지시자로 잘 알려져 있다(Warwick et al.[2002]; Ysebaert et al.[2002]). 대형저서무척추동물의 시공간분포는 하구생태계를 이해할 수 있는 중요한 기초정보를 제공해 주며(Ysebaert et al.[2003]), 이러한 시공간분포는 염분과 퇴적물 조성에 의해 주로 결정되는 것으로 전통적으로 알려져 있다(Millet and Guelorget[1994]; Ysebaert et al.[2005]; Sousa et al.[2006]; Fujii[2007]; Ryu et al.[2011a]; Kim et al.[2016]). 그러나 저서동물은 종, 개체군, 군집 수준 모두에 걸쳐 인간에 의한 영향에 상대적으로 민감하기 때문에 훼손된 하구역의 저서동물 군집은 자연환경 만으로는 설명할 수 없게 된다(Bayne et al.[1988]; Day et al.[1989]; Pearson and Rosenberg[1978]).
금강 하구는 1983년 이전에는 자연하구였으나 1983년부터 1988년에 걸쳐 하구둑이 완공되어 자연하구의 기능을 상실하였다. 또한 1990년에 시작된 북측도류제와 1992년에 시작된 남측도류제 및 북방파제 공사, 그리고 1991년부터 2006년까지 새만금을 개발하기 위한 새만금방조제공사가 진행되었다(Koh et al.[2010]; Suh[2004]; Sung[2017]). 금강하구둑 건설 직후인 1988년 조사를 통해 금강하구역의 대형저서동물군집에 대한 특징적인 공간분포가 보고된 바 있으며(Choi and Koh[1994]), 2014년에 저서군집 공간분포와 환경요인의 관계가 연구된 바 있으나(Yoon et al.[2017]) 이들 연구는 모두 1회조사로 계절적 변동을 조사하지 않았다. 그러나 2015년부터 수행되고 있는 국가해양생태계 종합조사에서 금강 하구역의 4개 정점을 대상으로 계절조사를 하고 있다. 우리나라 다른 하구역의 대형저서동물군집에 대한 연구들로는 경기만을 포함한 한강 하구역(Hong and Yoo[1996]), 영광 와탄천 하구역(Lim and Hong[2002]), 영산강 하구역(Lim and Park[1999]; Lim and Seo[2011]; Park et al.[2000]), 섬진강 하구역(Choi et al.[2003a]; Choi et al.[2003b]; Kang et al.[2014]; Lim et al.[2012]; Seo et al.[2017]), 낙동강 하구역(Lee et al.[2005]; Park et al.[2016]; Seo et al.[2016]; Yoon et al.[2011]), 태화강 하구역(Kim et al.[2016]; Yoon et al.[2009]) 등이 있으며 이들 연구에서는 대부분 시공간분포를 함께 제시하였다.
본 연구는 금강 하구역을 대상으로 한 하구역 종합관리시스템 개발연구의 일환으로 수행되었다. 연구목적은 대형저서동물의 군집구조와 주요 우점종의 광범위한 시공간 분포를 파악하여 관리시스템 개발을 위한 기초정보를 제공하는 것이다. 이를 위한 연구가설은 금강 하구 외해역의 저서동물 군집은 염분과 퇴적환경에 의해 지배되며, 군집구조는 계절적 변동과 관련없이 연중 일정하게 유지된다는 것으로 정하였다. 연구결과를 바탕으로 저서생태계 피해를 최소화 할 수 있는 관리방향을 제안하였다.
2. 재료 및 방법
금강 하구역의 대형저서동물 군집구조를 파악하기 위해 2014년 12월과 2015년 2월, 4월, 6월까지 총 4회에 걸쳐 26개 정점을 대상으로 현장조사를 실시하였다(Fig. 1). 현장에서 개량형 van Veen Grab (입구면적 0.1 m2)을 사용하여 정점당 3회씩 퇴적물을 채취하여, 2회 채집된 시료는 1 mm 체를 이용하여 저서동물을 채집하였고, 1회 채집된 시료는 표층 2 cm 퇴적물을 채취하여 퇴적물 분석에 이용하였다. 채집된 저서동물은 10% 중성 포르말린으로 고정한 후 실험실로 운반하여 저서동물을 선별하였다. 저서동물은 현미경을 이용하여 종 수준까지 동정하여 개체수를 세었다. 각 종별로 생물량을 분석하기 위하여 0.001g까지 측정할 수 있는 전자저울을 사용하여 습중량을 측정하였다.
표층퇴적물 입도분석은 시료를 약 20 g 정도를 취하여 과산화수소(H2O2)을 이용하여 유기물을 제거하였다. 처리된 시료는 표준체 4ø를 이용하여 조립질 퇴적물과 세립질 퇴적물로 분리하였다. 조립질 퇴적물은 표준체를 이용하여 건식체질법을 이용하였고 세립질 퇴적물은 침전속도를 이용한 피펫법으로 분석하였다. 퇴적물 입도별 함량의 누적빈도를 이용하여 평균입도, 분급도, 니질함량을 구하였다(Folk and Ward[1957]).
퇴적물 유기물함량은 강열감량법(Loss on Ignition, LOI)을 이용하여 분석하였다. 분석방법은 습시료의 습중량을 측정하고 건조기를 이용하여 70 oC에서 72시간이상 건조시켜 후 막자사발을 이용하여 분말시료로 만든 다음 도가니에 2~3 g 정도를 취하여 고온전기로를 이용하여 550 oC에서 4시간동안 강열하였다. 강열된 시료의 무게를 전자저울을 이용하여 0.001 g까지 측정하고 강열전과 후의 무게 차이를 계산하여 유기물함량(%)을 산출하였다. 건조 및 강열 시료의 무게를 측정하기 전에 실리카겔 데시케이터에서 충분히 식혀 공기 중 습도에 의한 영향을 최소화 하였다.
생태지수로는 Shannon 다양성지수(Shannon and Weaver[1963]), Margalef 종풍부도지수(Margalef[1958]), Pielou 균등도지수(Pielou[1966]), McNaughton 우점도지수(McNaughton[1968])를 계산하였다. 대형저서동물의 종조성이 유사한 정점군을 분류하기위해 집괴분석(cluster analysis)을 수행하였다. 출현한 모든 종의 개체수 자료를 log(x+1) 변환을 한 뒤 Bray-Curtis 유사도지수(Bray and Curtis[1957])를 계산하고 그룹평균결합법을 이용하여 수지도를 작성하였다. 집괴분석은 Primer (ver. 5.2.8)을 이용하였다.
3. 결과 및 고찰
3-1. 저서환경
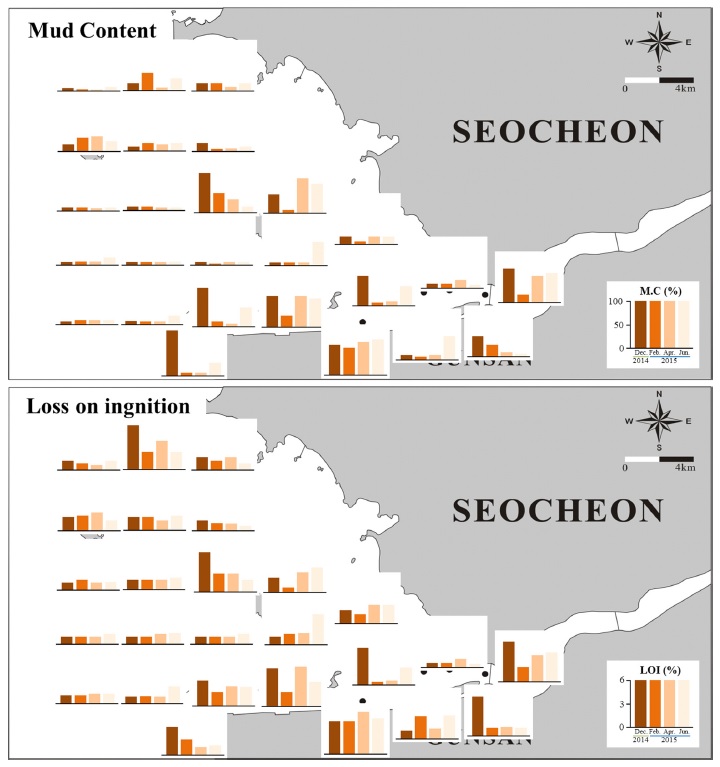
금강하구역의 퇴적환경은 하구둑 입구에서는 니질함량과 유기물 함량이 높고 외해역으로 가면서 감소하는 경향을 보였다(Fig. 2). 하구둑이 완공된 직후인 1988년에 조사된 연구결과에서도 퇴적상의 공간분포는 유사하게 나타났으나(Choi and Koh[1994]), 1988년에서 2000년까지 수치수동역학모형을 이용한 모의에서 하구둑 건설 이후 조석에너지 차단으로 인하여 금강하구 입구해역은 세립질 환경의 진행속도가 더 증가하고 있는 것으로 보고된 바 있다(Suh[2004]). 시기별 퇴적환경의 변화는 수심이 얕고 육지와 가까운 정점 들에서 사질과 니질퇴적상이 교차하는 심한 변화를 보였고, 외해에 위치한 정점들은 조사기간 동안 일정한 사질환경을 보였다. 금강하구 전해역의 니질함량 시기별 변화를 보면 2014년 12월에 29.8±30.8%로 가장 높았으며, 2015년 2월에 14.3±15.8%으로 낮아졌다가, 4월 19.2±23.3%, 6월 27.5±22.0%로 점차 증가하는 경향을 보였으나 그 차이는 통계적으로 유의하지 않았다(p=0.07). 유기물 함량도 니질함량과 유사한 경향을 보였는데 2014년 12월에 2.6±1.5%로 가장 높았고, 2015년 2월에 1.8±0.8%로 낮아졌다가, 4월 2.2±1.1%, 6월 2.4±1.0%로 점차 높아졌으나 그 차이는 통계적으로 유의하지 않았다(p=0.06). 따라서 조사기간 동안 금강하구역의 퇴적환경의 시기별 변화는 정점에 따라 차이는 있으나 전반적으로 일정한 상태를 유지하고 있음을 알 수 있다. 그러나 본 연구의 정점 1-11번 까지의 해역은 군장항 항로지역으로 2007년-2018년 동안 2단계에 걸친 항로준설 사업을 통해 약 2340만 m3의 퇴적물이 준설되는 등 퇴적환경에 영향을 줄 수 있는 다양한 개발사업이 진행되어 왔다. 본 조사기간 동안 수로해역에서의 퇴적환경은 하구역 다른 해역에 비해 변화가 심한 것으로 나타나 저서동물 군집에 불안한 환경을 제공하고 있는 것으로 여겨진다.
3.2 대형저서동물군집
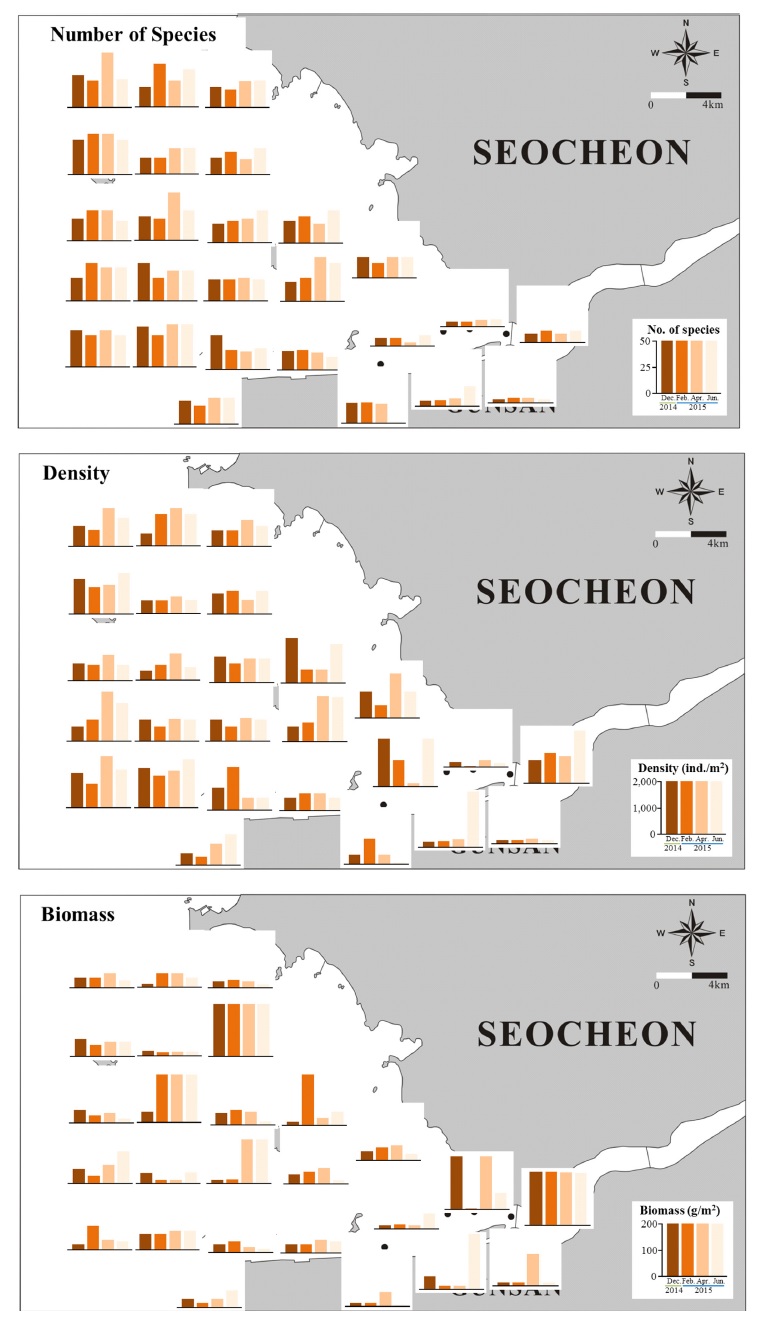
조사기간동안 채집된 대형저서동물의 전체 출현종수는 211종이며, 분류군별로는 다모류(46.4%), 갑각류(27.0%), 연체동물(19.0%)의 순으로 높게 나타났다. 조사시기별로는 2014년 12월에는 137종으로 가장 적었고, 2015년 4월에 154종으로 가장 많았다(Table 1). 분류군별 출현종수는 조사시기에 걸쳐 다모류, 갑각류, 연체동물의 순서로 일정하였다. 정점별로는 하구둑 근방에서는 생물다양성이 낮고 외해역으로 갈수록 높아졌다. 금강하구 입구해역(정점 1~5번)은 15종 이하의 낮은 출현종수를 보였으나 외해역(정점 10~11, 15~16, 19~26번)에서는 30종 이상의 다양한 저서동물이 서식하였다(Fig. 3). 금강 하구역의 기존조사에서 보고된 출현종수를 비교해 보면, 1988년에 7개 정점에서 1회 조사된 연구에서는 총 35종이 출현하였고(Choi and Koh[1994], Lee[2012]는 2007년-2010년 조사에서 평균 63종의 다모류가 출현함을 보고하였으나 이들 연구는 본 연구결과와 정점수 및 동정된 분류군규모가 차이를 보여 직접 비교는 어렵다. 금강 하구역과 유사하게 하구둑이 존재하는 영산강과 낙동강 하구역의 연구결과와 비교해 보면 Lim and Seo[2011]는 영산강 하구 40개 정점의 1회조사에서 1995년에 141종, 2006년에 113종을 보고하였고, Seo et al.[2016]은 낙동강 하구 8개 정점에서 2013년-2015년 12회 계절조사를 통해 266종이 출현한다고 하였다. 염분 구배가 뚜렷한 자연하구인 섬진강 하구에서 Seo et al.[2017]는 7개 정점을 대상으로한 2015-2016년 5회 계절조사에서 163종을 보고하였다. Lim et al.[2012]은 광양만 북부 수어천 하구의 24개 정점에서 2009년 하계 1회조사를 통해 총 44종을 관찰하였다. 다른 하구역과의 총 출현종수를 비교하는 것은 조사규모, 퇴적상의 이질성 등에 따라 달라지기 때문에 조심스럽게 접근해야 하나, 본 연구와 비슷한 규모의 연구에서 보고된 낙동강 하구역의 266종(Seo et al.[2016]), 섬진강 하구역의 163종(Seo et al.[2017])과 비교하면 금강 하구역의 생물다양성은 비슷한 수준으로 여겨진다.
전체 평균서식밀도는 941 ind./m2이며, 분류군별 서식밀도는 다모류(57.5%), 갑각류(25.8%), 연체동물(12.4%) 순으로 높았다. 조사시기별 서식밀도는 718~1,319 ind./m2의 범위를 보였으며 2014년 12월, 2월의 겨울철에는 낮고 4월, 6월로 가면서 높아지는 경향이 나타났다(Table 1). 분류군별 서식밀도는 조사시기에 걸쳐 다모류, 갑각류, 연체동물 순으로 일정한 경향을 보였다. 정점별로는 하구둑 인근 수로해역(정점 2~7)에서 낮은 서식밀도를 보였으나 가장 안쪽의 정점 1에서는 기회종의 출현유무에 따라 높은 서식밀도를 보였고 변화폭도 컸다. 전반적으로 외해역의 서식밀도가 높은 값을 보였다. Choi and Koh[1994]가 관찰한 평균 서식밀도 1,290 ind./m2는 본 연구결과와 유사한 수준으로 나타났다. 영산강 하구역의 경우 1995년에 1,979 ind./m2, 2006년에 750 ind./m2으로 나타났다(Lim and Seo[2011]). 낙동강 하구역에서는 859 ind./m2였고(Seo et al.[2016]), 섬진강 하구역에서는 1,865 ind./m2였다(Seo et al.[2017]). 이들 하구역의 저서동물 서식밀도는 대체적으로 비슷한 수준인 것으로 판단된다.
전체 평균생물량은 153.1 g/m2이며, 분류군별로는 연체동물(73.1%), 극피동물(14.3%), 다모류(7.8%)이 우점하였다. 조사시기별 생물량은 2014년 12월, 2015년 2월, 4월에 걸쳐 90~100 g/m2의 수준을 보이다가 6월에 3배 이상 증가하였다(Table 1). 분류군별 생물량은 조사시기에 걸쳐 연체동물, 극피동물, 다모류 순으로 높았으나, 2015년 4월에는 연체동물(63.6%), 다모류(14.3%), 극피동물(12.9%) 순으로 높게 나타났다. 하구둑 인근 수로해역(정점 1~4)에서 기수종인 쇄방사늑조개(Potamocorbula amurensis) 출현 여부에 따라 높은 생물량이 나타났고 시기별 변동폭도 컸으며, 외해역에서는 개량조개(Mactra chinensis)와 모래무지염통성게(Echinocardium cordatum)가 출현한 정점14, 17, 19, 21에서 200 g/m2 이상의 높은 생물량을 보였다. 가장 높은 생물량을 기록한 경우는 2015년 6월에 정점 14에서 M. chinensis가 3,900 g/m2 출현한 것이다.
Shannon 종다양성지수와 Margalef 종풍부도지수는 출현종수가 가장 많은 2015년 4월에 가장 높은 값을 보여, 출현종수를 반영하는 것으로 나타났다. 반면에 Pielou 종균등도지수는 2015년 6월이 낮고 나머지 세 조사시기는 비슷한 값을 보여 다른 양상을 나타냈는데, 이는 2015년 6월의 우점도지수가 다른 시기보다 높기 때문이다. 생태지수의 시기별 평균차이는 통계적으로 유의하지 않았다.
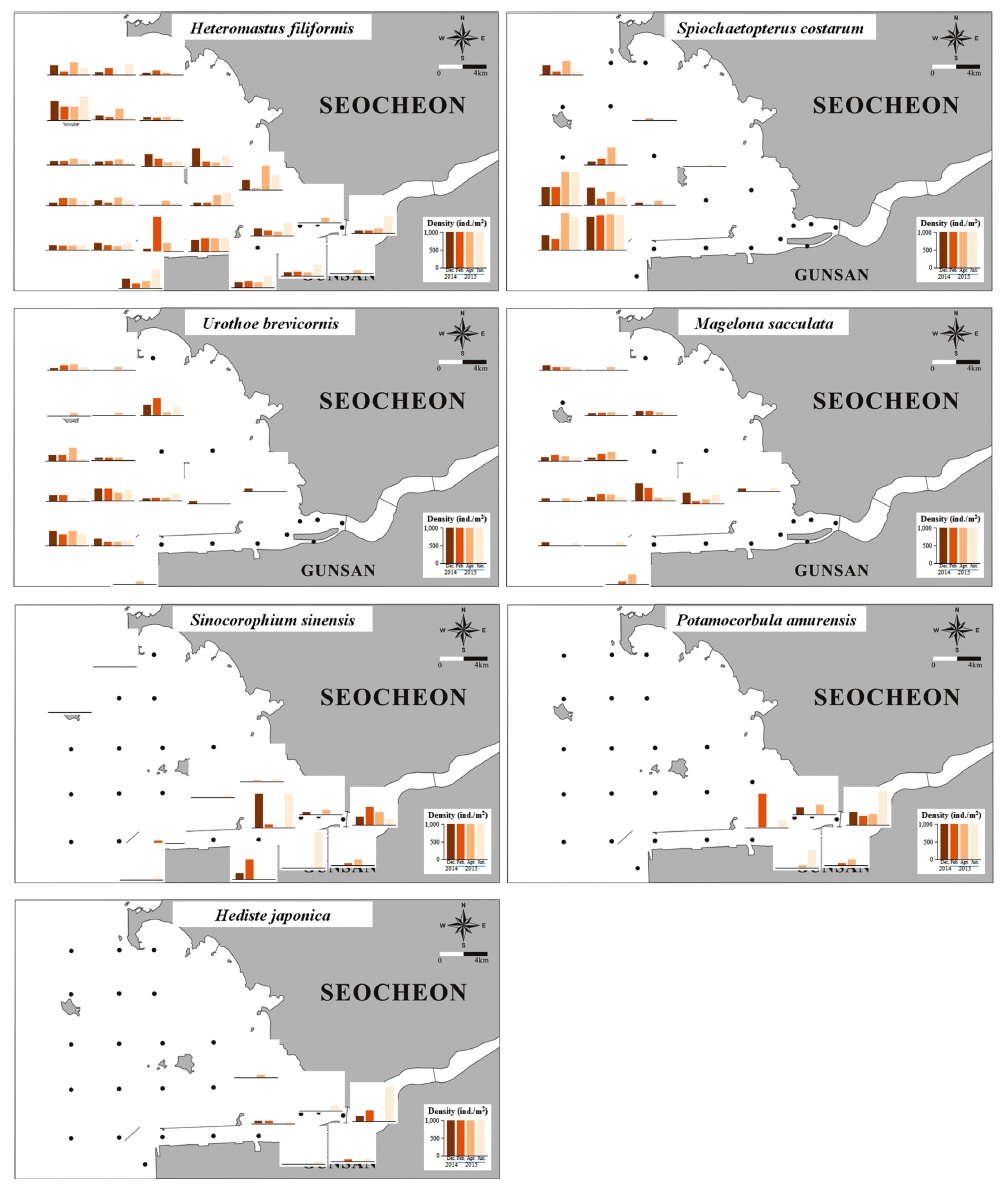
금강 하구역에서 채집된 대형저서동물 중 개체수 상위 2%이상을 차지하는 우점종은 9종이였으며, 분류군으로는 환형동물 5종, 절지동물 2종, 연체동물 2종이고 이들은 전체개체수의 53.7%를 차지하였다(Table 2). 첫 번째 우점종인 고리버들갯지렁이(Heteromastus filifromis)는 전체 개체수의 13.9%를 차지하였고 평균서식밀도는 전체 정점기준 131.0 ind./m2, 출현 정점기준 144.9 ind./m2였다. 조사기간 동안 전체 정점의 90.4%에서 출현하였으며 각 정점에서의 시기별 서식밀도도 일정하게 나타났다. 하구둑 인근 정점 1과 군산항 인근 정점 8, 개야수로 입구 정점 12를 제외하면 각 정점에서의 시기별 서식밀도 변화는 크지 않아 전반적으로 계절에 관계없이 연중 꾸준히 우점하고 있는 것으로 나타났다(Fig. 4). 이 종은 우리나라 및 전세계 연안에서 유기물 오염이 진행된 해역에서 높은 밀도로 출현하는 유기물오염 지시종으로 많이 보고되어 있다(Jang and Shin[2016]; Pearson and Rosenberg[1978]; Ryu et al.[2011b]). 국내에서는 1980년대 후반부터 전국 연안에 걸쳐 우점종으로 서식하고 있음이 보고되어 왔으나(Shin et al.[1989]; Choi and Koh[1994]) 2016년에 와서야 국문학명인 고리버들갯지렁이로 불리게 되었다(Choi and Yoon[2016]). H. filiformis는 유기물 오염지시종으로 유명한 등 가시버들갯지렁이(Capitella capitata)에 비해서는 상대적으로 덜 오염된 환경에서 머리를 아래로 향한 채로(head-down deposit feeder) 서식하는 퇴적물 식자이며(Clough and Lopez[1993]; Ryu et al. [2011b]), 퇴적물의 통기성을 확보하여 C. capitata를 배척하고 저서동물 군집의 생물다양성에 긍정적인 효과를 주는 것으로 알려져 있다(Thrush et al.[1992]). 이 종의 출현은 1970-80년대 연구에서는 잘 보고되지 않았으나(Frey et al.[1987]; Koh and Shin[1988]; Lee et al.[1983]; Lee[1987]; Oh and Kim[1976]), 90년대 들어와서 우점종으로 많이 보고되고 있는 것은 연구가 많아졌기 때문일 수도 있으나 보다 근본적으로는 연안역 개발에 따른 육상기인 오염물질의 유입으로 인해 저서환경의 유기물 농도가 증가한 것을 반영한다고 볼 수 있다. H. filiformis의 서식밀도와 퇴적물 유기물 함량 간에는 양의 상관관계를 보여주는 결과는 많으며 본 연구에서도 유의한 양의 상관관계를 보여주었다(p<0.05). 그러나, 우리나라 연안의 우점종인 H. filiformis를 유기물 오염지시종으로 볼 것인가에 대해서는 논란의 여지가 있다. 본 연구에서 H. filiformis가 출현한 94개 정점에서 출현종수가 30종 이상인 경우가 42개 정점에 달해 생물다양성이 상당히 높은 환경에서 이 종이 서식하고 있는 것을 알 수 있다. 따라서, H. filiformis는 유기물 농도가 비교적 높은 환경을 선호하며 저서군집의 생물다양성에 긍정적인 영향을 주는 생물종으로 지칭하는 것이 타당할 것이다.
두 번째 우점종은 전체 개체수의 11.6%를 차지한 Spiochaetopterus costarum로 평균서식밀도는 전체 정점기준 109.3 ind./m2, 출현 정점기준 406.1 ind./m2이며 전체 정점의 26.9%에서 출현하였다. 아직 국문학명이 없는 이 종은 날개갯지렁이과(Family Chaetopteridae)에 속하며 모래입자를 이용하여 관을 만들어서 생활하는 다모류로 몸 앞쪽에 위치한 잎모양 등다리(anterior foliaceous notopodia)에서 분비하는 점액질을 이용하여 관 내부의 부유퇴적물을 흡착한 둥근형태의 먹이입자(food ball)를 만들어 이를 섭식하므로 부유물식자로 분류할 수 있다(Barnes[1964]). 금강하구로부터 가장 먼바다에 위치한 정점(정점 10, 11, 15, 16, 19, 26)에 주로 서식하였으며(Fig. 4), 니질함량 0.04-20.3%, 유기물함량 0.98-2.94% 범위의 사질퇴적상 환경을 선호하였다. 그러나, 이 종의 서식밀도는 입도나 유기물 함량과 유의한 상관관계를 보이지 않았다(Table 2).

Density, frequency, and habitat’s environmental range of density-based dominant species of macrozoobenthos occurring in Geum River estuary
세번째 우점종은 전체 개체수의 11.4%를 차지한 Sinocorophium sinensis로 전체 정점기준 107.3 ind./m2, 출현 정점기준 531.4 ind./m2의 평균서식밀도로 전체 정점의 20.2%에서 출현하였다. 육질꼬리옆새우과(Family)에 속하는 이 종은 아직 국문학명이 없으며 퇴적물 속에 구멍을 파고 서식하면서 좁은 공간범위에서 매우 높은 밀도를 보이는 것이 특징이다(Ryu et al.[2011a]). 출현종수가 낮았던 금강하구 입구해역(정점 1~6)에서 쇄방사늑조개(P. amurensis)와 함께 높은 밀도로 우점하였다(Fig. 4). 출현한 정점들의 니질함량은 4.0-74.8%, 유기물함량은 1.11-5.36%로 비교적 넓은 퇴적상 범위에 서식하는 것으로 보이나, 공간범위가 준설과 침퇴적이 활발한 하구둑 인근에 제한적으로 분포하는 것을 고려할 때 담수의 영향을 받고 물리적 교란이 심한 환경에 서식하는 것으로 볼 수 있다.
네 번째 우점종인 쇄방사늑조개(Potamocorbula amurensis)는 전체 개체수의 4.1%를 차지하였고, 평균서식밀도는 전체 정점기준 38.2 ind./m2, 출현 정점기준 305.4 ind./m2로 전체 정점의 12.5%에서 출현하여 좁은 범위의 해역에서 높은 밀도로 서식하였다. 동아시아의 토착종으로 1986년에 미국 샌프란시스코만에 침입하여 독자적인 개체군을 형성하고 있으며, 기수역에서 해역까지 사질과 니질퇴적상을 포함하는 넓은 서식환경에 적응할 수 있으며 박테리아에서 요각류 유생까지 다양한 먹이원을 이용하는 능력을 지닌 여과물식자이다(Parchaso and Thomson[2002]). 1988년 조사에서는 금강하구 입구에서 비응도까지 높은 밀도로 우점하여 출현하였으나(Choi and Koh[1994]), 30년이 지난 본 조사에서는 서식범위가 금강하구 입구에서 유부도까지로 축소되었다. 출현 정점들의 니질함량은 0.9-74.8%, 유기물함량은 0.92-5.36%의 범위를 보여 다양한 퇴적상에 서식하였다. S. sinensis와 서식지가 겹치나 더 좁은 공간범위를 보이며, 담수의 영향을 받으면서 물리적 교란이 심한 하구환경에 서식하는 것으로 판단된다.
다섯 번째 우점종은 전체 개체수의 3.3%를 차지하는 Urothoe brevicornis로 평균서식밀도는 전체 정점기준 31.4 ind./m2, 출현 정점기준 79.8 ind./m2를 보였다. 이 종은 S. costarum과 유사하게 주로 사질퇴적상의 외해역에 분포하나 전체 정점 중 39.4%에서 출현하여 보다 넓은 서식범위를 보였다. 아직 국문학명이 정해지지 않았으며 모래무지옆새우사촌과(Family Urothoidae)에 속하는 단각류로 사질퇴적상의 표층에 서식하는 퇴적물식자이다(Sanchez-Mata et al.[1993]). 본 조사에서 출현한 정점들의 니질함량은 0.01-22.0%, 유기물함량은 0.98-4.44%의 범위를 보였다.
여섯 번째 우점종은 전체 개체수의 2.7%를 차지하는 개량조개(Mactra chinensis)로 평균서식밀도는 전체 정점기준 25.2 ind./m2, 출현 정점기준 138.2 ind./m2이며 전체 정점의 18.3%에서 출현하여 좁은 서식범위를 보였다. 특히 개야도 남쪽에 위치한 정점 14에서 조사시기 내내 높은 서식밀도(평균 553.8 ind./m2)로 출현하였다.
일곱 번째 우점종은 전체 개체수의 2.3%를 차지하는 Magelona sacculata로 평균서식밀도는 전체 정점기준 21.3 ind./m2, 출현 정점기준 50.5 ind./m2였으며 전체 정점의 42.3%에서 출현하였다. 이 종은 사질퇴적상의 외해역에 서식하는 S. costarum, U. brevicornis과 유사한 공간분포를 보이나 좀더 넓은 범위에서 출현하였다. 출현한 정점들은 니질함량 0.01-48.29%, 유기물함량 0.98-4.44%의 범위를 보였다.
여덟 번째 우점종은 전체 개체수의 2.2%를 차지하는 Sigambra tentaculata로 평균서식밀도는 전체 정점기준 20.7 ind./m2, 출현 정점기준 36.4 ind./m2이며 전체 정점의 56.7%에서 출현하여 H. filiformis 다음으로 가장 넓은 서식공간 범위를 보였다. 이 종은 니질함량 0.04-95.6%, 유기물함량 0.98-5.36%의 범위에서 출현하였다.
아홉 번째 우점종은 전체 개체수의 2.2%를 차지하는 Hediste japonica로 평균서식밀도는 전체 정점기준 20.5 ind./m2, 출현 정점기준 193.6 ind./m2이며, 전체 정점의 10.6%에서 출현하여 9개 우점종 중에서 가장 좁은 공간범위를 보였다. 이 종은 참갯지렁이과(Family Nereidae)에 속하며 염분이 낮은 기수역에서 높은 밀도로 서식하는 것으로 알려져 있다(Kang et al.[2014]; Lim[2007]; Sato and Nakashima[2003]; Sato[2004]). 본 조사에서는 금강하구둑 인근에 위치한 정점 1에서 높은 서식밀도를 보였으며 2015년 4월에는 전혀 출현하지 않았다. 출현한 정점의 니질함량은 0.9-74.8%, 유기물함량은 0.92-5.36%로 P. amurensis와 동일했으나 공간범위는 P. amurensis보다 좁게 나타났다. 이는 염분이 낮은 기수역에 서식하는 특성에 의한 것이며 금강 하구둑으로부터 담수가 불규칙하게 방류되기 때문에 시기별 출현변화가 심한 것으로 여겨진다.
금강 하구역과 마찬가지로 하구둑이 건설되어 있는 낙동강, 영산강 하구역의 대형저서동물 우점종을 비교해 보면 차이를 보인다. 낙동강 하구역에서는 다모류인 Sternaspis chinensis, Goniada maculata, H. filiformis가 우점하였다(Seo et al.[2016]). 낙동강 하구역의 우점종이 다른 이유는 지리적 거리가 멀고, 낙동강 하구둑 인근 해역은 조립한 사질퇴적상이며, 외해는 니질함량이 높아 금강 하구역과는 상이한 퇴적상 분포를 보이기 때문이다. Lim and Seo[2011]은 영산강 하구역의 우점종으로 애기반투명조개(Theora fragilis), 다모류인 Tharyx sp.와 긴자락송곳갯지렁이(Lumbrineris longifolia)를 보고하였다. 영산강하구는 반폐쇄적인 만으로 육상에서 유입된 유기물이 외해로 나가지 못하고 정체되어 저층에 쌓이게 되어 유기물 오염지시종들이 우점한 결과로 인해 본 조사와 차이를 보이다고 판단된다. 영산강 하구의 우점종들은 본 연구에서도 출현하였으며, 특히 유기물 오염지시종인 T. fragilis는 군산항 수로 정점 7에서 집중적으로 출현하였으며, 본 연구에서는 이 종을 World Register of Marine Species의 권고에 따라 Theora lata로 명명하였다.
금강 하구역의 26개 정점에서 4회 조사된 대형저서동물의 개체수 자료를 이용하여 집괴분석을 실시한 결과 4개의 정점군으로 구분되었다(Fig. 5). 공간적으로 금강 하구입구에서 외해역으로 갈수록 정점군이 순차적으로 배열되는 양상을 보였다. 외해역은 남쪽(정점군 A)과 북쪽해역(정점군 B)으로 구분되었다. 외해역 남쪽에 위치한 정점군 A는 36개 정점으로 구성되며 니질함량이 5.4±5.0%, 유기물함량이 1.5±0.4%로 가장 낮은 값을 보였다(Table 3). 출현종수는 가장 많은 156종이며, 평균 서식밀도는 1,071 ind./m2 이였다. 생태지수는 높은 종다양성을 지시하고 있으나 출현종수가 148종인 정점군 B의 생태지수가 더 높은 다양도를 보여주었다. 이는 생태지수 계산식에서 Shannon 다양도지수와 Pielou 균등도지수는 우점도에 의한 영향을 받고, Margalef 종풍부도지수는 같은 종수라도 서식밀도가 낮은 경우에 높은 값을 보이기 때문이다. 따라서 종수가 낮은 정점군 B가 더 양호한 생태지수를 보인 이유는 정점군 A의 우점도가 정점군 B에 비해 더 높고 정점군 B의 서식밀도가 더 낮은 사실에서 찾을 수 있다. 정점군 A의 우점종은 사질퇴적상에 서식하는 S. costarum, U. brevicornis, M. chinensis였다.
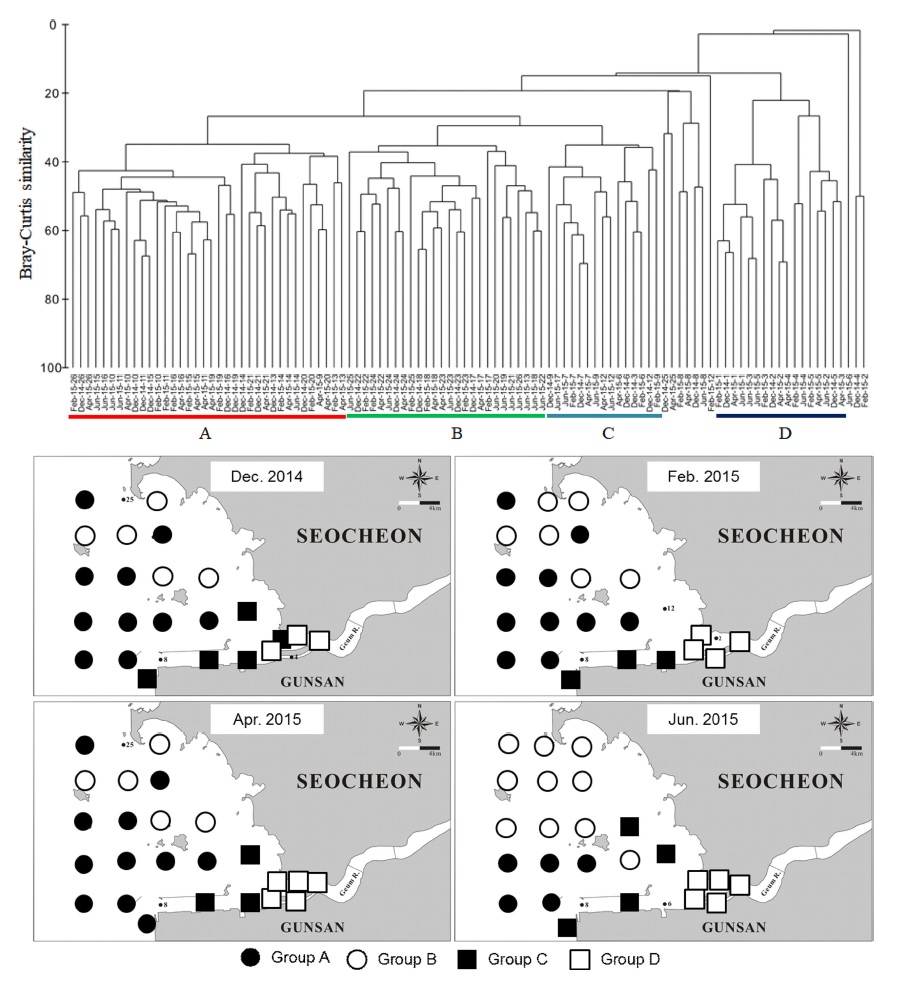
Map showing the station groups classified by the cluster analysis based on density data, and a dendrogram of macrozoobenthic communities in Geum River estuary.

Characteristics of benthic environment and macrobenthic community of each station group classified by cluster analysis in Geum river estuary
외해역 북쪽에 위치한 정점군 B는 정점군 A에 비해 니질함량이 다소 높은 사질퇴적상으로 유기물 함량도 다소 높았다(Table 3). 출현종수는 148종이었고, 평균 서식밀도는 4개 정점군 중에 가장 낮은 799 ind./m2로 나타났다. 생태지수는 가장 높은 종다양성을 지시했다. 우점종은 유기물 함량이 높고 사질퇴적상을 선호하는 H. filiformis, Aricidea sp., S. tentaculata들이 차지하였다.
정점군 C는 하구 입구와 외해역 중간에 위치하며 니질함량 47.3±25.5%, 유기물함량 3.4±1.1%로 가장 세립한 퇴적상을 보였다. 우점종은 유기물함량이 높고 니질퇴적상을 선호하는 H. filiformis, Theora lata, S. sinensis였다.
금강하구 입구에 위치한 정점군 D는 니질함량 22.1±24.3%, 유기물함량 2.2±1.2%로 가장 높은 편차를 보여, 물리적 교란이 심하고 유기물 함량이 높은 환경이 존재하였다. 출현종수는 가장 낮은 48 종이었으나 서식밀도는 가장 높은 1,088 ind./m2로 나타났다. 우점종은 S. sinensis, P. amurensis, H. japonica이며, 이 종들은 염분이 낮으면서 유기물 함량이 높거나 물리적 교란이 심한 환경에서 출현하는 종들이다. 본 조사기간에 측정된 해양환경측정망 자료를 통해 각 정점군의 염분차이를 파악한 결과 정점군 A, B, C의 평균 염분은 29-31psu의 범위였으나, 정점군 D는 24.3±3.5 psu의 낮은 염분을 보였다. 따라서 정점군 D는 낮은 염분을 선호하는 종이 우세하고, 정점군 A-C는 퇴적상과 유기물 함량의 차이가 반영된 결과로 정리해 볼 수 있겠다.
4. 결 론
연구는 준설, 매립 등 개발사업의 영향을 받고 있는 금강 하구역에 서식하는 대형저서동물군집의 시공간분포와 이를 결정하는 환경요인을 알아보기 위해 수행되었다. 금강 하구역에서는 물리적 교란, 염분, 퇴적상에 의해 뚜렷하게 구분되는 4개의 정점군이 조사기간에 걸쳐 안정적으로 분포하였다. 즉, 하구둑으로 막혀있는 환경임에도 불구하고 염분구배에 따르는 하구생태계의 특징을 보여주고 있다. 저서동물 군집으로 유추해 본 기수역 생태계의 범위는 금강하구둑으로부터 장항항 인근까지이며 물리적 교란이 심한 환경에 서식하는 종이 우점하고 있다. 따라서, 안정적인 하구생태계로 복원하기 위해서는 자연스러운 해수유통, 개발사업의 최소화가 요구된다.
우리나라 서남해의 우점종인 고리버들갯지렁이(Heteromastus filiformis)는 금강 하구역 전범위에 서식하며 저서생물 다양성에 기여하는 것으로 나타나 유기물 오염을 지시한다고 보기에 무리가 있으며, 과다한 서식밀도를 보이는 경우에 한해서 유기물 축적을 잠재적으로 지시하는 종(potential indicator species for organic enrichment)으로 보는 것이 타당하다. 이 종에 대한 분류, 생리, 생태, 개체군 등에 대한 지속적인 연구를 통해 우리나라 연안 저서생태계의 현 상태를 진단하고 미래변화에 대한 예측이 필요하다. 마지막으로 하구생태계에 대한 장기적인 모니터링 연구를 통해 육상기인 오염이 해양생태계에 주는 영향을 정량적으로 규명하여 향후 도입될 예정인 유역-하천-하구-연안을 잇는 해양생태축 관리를 위한 과학기반을 구축할 필요가 있다.
Acknowledgments
본 연구는 2018년 해양수산부의 “하구역 종합관리시스템 개발연구(금강하구역을 대상으로)”의 지원으로 수행되었습니다.
References
-
Barbier, E.B., Hacker, S.D., Kennedy, C., Koch, E.W., Stier, A.C., and Silliman, B.R., (2011), The Value of Estuarine and Coastal Ecosystem Services, Ecol. Monogr., 81(2), p169-193.
[https://doi.org/10.1890/10-1510.1]

-
Barnes, R.D., (1964), Tube-building and Feeding in the Chaetopterid Polychaete, Spiochatopterus oculatus, Biol. Bull., 127(3), p397-412.
[https://doi.org/10.2307/1539244]

-
Bayne, B.L., Clarke, K.R., and Gray, J.S., (1988), Background and Rationale to a Practical Workshop on Biological Effects of Pollutants, Mar. Ecol. Prog. Ser., 46, p1-5.
[https://doi.org/10.3354/meps046001]

- Bray, J.R., and Curtis, J.T., (1957), An Ordination of Upland Forest Community of Southern Wisconsin, Ecol. Monogr., 27, p325-349.
- Choi., J-W., and Koh, C-H, (1994), Macrobenthos Community in Keum-Mankyung-Dongjin Estuaries and its Adjacent Coastal Region, Korea, J. Oceanol. Soc. Korea, 29(3), p304-318.
- Choi, J-W, Hyun, S., and Chang, M, (2003a), The Summer Benthic Environmental Conditions Assessed by the Functional Groups of Macrobenthic Fauna in a Gwangyang Bay, Southern Coast of Korea, Korean J. Environ. Biol., 21, p101-113.
-
Choi, H.K., and Yoon, S.M., (2016), First Record of Heteromastus filiformis (Polychaeta: Capitellidae) from Korean Waters, with a Taxonomic Note on the Genus, J. Species Res., 5(3), p264-271.
[https://doi.org/10.12651/jsr.2016.5.3.264]

- Choi, J-W, Yu, O-H, and Lee, W-J, (2003b), The Summer Spatial Distribution Pattern of Macrobenthic Fauna in Gwangyang Bay, Southern Coast of Korea, J. Korean Soc. Oceanogr.「The Sea」, 8, p14-28.
- Clough, L.M., and Lopez, G.R., (1993), Potential Carbon Sources for the Head-down Deposit-feeding Polychaete Heteromastus filiformis, J. Mar. Res., 51, p595-616.
- Costanza, R., Kemp, W.M., and Boynton, W.R., (1993), Predictability, Scale, and Biodiversity in Coastal and Estuarine Ecosystems: Implications for Management, Ambio, 22, p88-96.
- Costanza, R., d'Arge, R., de Groot, R., Farber, S., Grasso, M., Hannon, B., Limburg, K., Naeem, S., O'Neill, R.V., Paruelo, J., Raskin, R.G., Sutton, P., and van den Belt, M., (1997), The Value of the World’s Ecosystem Services and Natural Capital, Nature, 387, p253-260.
- Day, J.W. Jr., Hall, C.A.S., Kemp, W.M., and Yanez-Arancibia, A., (1989), Estuarine Ecology, John Wiley, New York, p558.
- Davidson, N.C., d’A Laffoley, D., Doody, J.P., Way, L.S., Gordon, J., Key, R., Drake, C.M., Pienkowski, M.W., Mitchell, R., and Duff, K.L., (1991), Nature Conservation and Estuaries in Great Britain, Peterborough, Nature Conservancy Council, p422.
- Folk, R.L., and Ward, W.C., (1957), Brazos River Bar: a Study in the Significance of Grain Size Parameters, J. Sediment. Petrol., 27, p3-26.
- Frey, R.W., Hong, J.-S., Howard, J.D., Park, B.-K., and Han, S.-J., (1987), Zonation of Benthos on a Macrotidal Flat, Inchon, Korea, Senck. Marit., 19(5/6), p295-329.
-
Fujii, T., (2007), Spatial Patterns of Benthic Macrofauna in Relation to Environmental Variables in an Intertidal Habitat in the Humber Estuary, UK: Developing a Tool for Estuarine Shoreline Management, Estuar. Coast. Shelf Sci., 75, p101-119.
[https://doi.org/10.1016/j.ecss.2007.02.027]

- Gray, J.S., (1997), Marine Biodiversity: Patterns, Threats and Conservation Needs, Biodivers. Conserv., 6, p153-175.
-
Gray, J.S., (2002), Species Richness of Marine Soft Sediments, Mar. Ecol. Prog. Ser., 244, p285-297.
[https://doi.org/10.3354/meps244285]

- Hong, J.-S., and Yoo, J.W., (1996), Salinity and Sediment Types as Sources of Variability in the Distribution of the Benthic Macrofauna in Han Estuary and Kyonggi Bay, J. Oceanol. Soc. Korea, 31, p217-231.
-
Jang, S.Y., and Shin, H.-C., (2016), Differences in the Community Structures of Macrobenthic Polychaetes from Farming Grounds and Natural Habitats in Gamak Bay, J. Korean Soc. Mar. Environ. Energy, 19(4), p297-309.
[https://doi.org/10.7846/jkosmee.2016.19.4.297]

-
Kang, S.H., Lee, J.H., Park, S.W., and Shin, H.C., (2014), Temporal and Spatial Distribution of Benthic Polychaetous Communities in Seomjin River Estuary, J. Korean Soc. Oceanogr. 「The Sea」, 19, p243-255.
[https://doi.org/10.7850/jkso.2014.19.4.243]

-
Kim, H.-C., Choi, B.-M., Jung, R.-H., Lee, W.-C., Yun, J.-S., and Seo, I.-S., (2016), The Community Structure of Macrobenthic Assemblages in the Taehwa River Estuary, Ulsan, Korea, J. Korean Soc. Mar. Environ. Saf., 22(6), p694-707.
[https://doi.org/10.7837/kosomes.2016.22.6.694]

-
Koh, C.H., and Shin, H.C., (1988), Environmental Characteristics and Distribution of Macrobenthos in a Mudflat of the West Coast of Korea (Yellow Sea), Neth. J. Sea Res., 22(3), p279-290.
[https://doi.org/10.1016/0077-7579(88)90030-0]

- Koh, C.-H., Ryu, J., and Khim, J.S., (2010), The Saemangeum: History and Controversy, Korean Soc. Mar. Environ. Eng., 13(4), p327-334.
- Lee, H.-G., Lee, J.-H., Yu, O.H., and Kim, C.-K., (2005), Spatial Characteristics of the Macrobenthos Community near the Nak-dong River Estuary, Ocean Polar Res., 27(2), p135-148.
- Lee, J.-H., (1987), Distributional Pattern of Polychaetes in the Benthic Community of the Yellow Sea, Bull. Korean Fish. Soc., 20(3), p224-229.
- Lee, J.H., Hong, J.-S., and Yi, S.K., (1983), Studies on the Benthic Fauna in Garolim Bay, Korea, J. Oceanol. Soc. Korea, 18(2), p111-116.
- Lim, H.-S., and Hong, J.-S., (2002), Spatial Distribution of Macrobenthos along the Salinity Gradient and Sedimentary Environment in the Watancheon Estuary, Beobseongpo, Southern Coast of Korea, J. Oceanol. Soc. Korea, 7, p8-19.
- Lim, H.-S., and Park, K.-Y., (1999), Community Structure of Macrobenthos in the Subtidal Soft Bottom in Semi-enclosed Young-san River Estuarine Bay, South Coast of Korea, Korean J. Fish. Aquat. Sci., 32(3), p320-332.
-
Lim, H.-S., and Seo, C.-H., (2011), Structure Change of Macrozoobenthic Communtiy after 10 years in Youngsan River Estuarine Bay, Southwest Coast of Korea, J. Korean Soc. Oceanogr. 「The Sea」, 16(4), p254-267.
[https://doi.org/10.7850/jkso.2011.16.4.254]

-
Lim, H.-S., Choi, J.-W., and Choi, S.-D., (2012), Spatial Distribution of Macrobenthos in Sueocheon Stream Estuary at the Northern Part of Gwangyang Bay, Korea, J. Korean Soc. Oceanogr. 「The Sea」, 17, p76-86.
[https://doi.org/10.7850/jkso.2012.17.2.076]

- Lim, K.-H., (2007), Long-term Variation of Benthic Environment and Macrofaunal Community on Tidal Flat with the Progress of Saemangeum Sea Dike Construction, Ph.D. dissertation, Chonnam National University.
- Margalef, R., (1958), Information Theory in Ecology, Gen. Syst., 3, p157-175.
- McLusky, D.S., (1989), The estuarine ecosystem, Blackie & Son, Glasgow and London, Chapman & Hall, New York, p150.
- McLusky, D.S., (1993), Marine and Estuarine Gradients- An Overview, Neth. J. Aquat. Ecol., p489-493.
-
McNaughton, S.J., (1968), Structure and Function in California Grasslands, Ecology, 49, p962-972.
[https://doi.org/10.2307/1936547]

-
Maurer, D., and Vargas, J.A., (1984), Diversity of Soft-bottom Benthos in a Tropical Estuary: Gulf of Nicoya, Costa Rica, Mar. Biol., 81, p97-106.
[https://doi.org/10.1007/bf00397631]

-
Millet, B., Guelorget, O., (1994), Spatial and Seasonal Variability in the Relationships Between Benthic Communities and Physical Environment in a Lagoon Ecosystem, Mar. Ecol. Prog. Ser., 108, p161-174.
[https://doi.org/10.3354/meps108161]

- Odum, E.P., (1983), Basic ecology, Saunders College Publishing, Philadelphia, p613.
- Oh, I.S., and Kim, W.S., (1976), The Polychaetous Annelid and Environment in the Intertidal Flat, Inchon, Korea, J. Oceanol. Soc. Korea, 11(2), p71-76.
- Parchaso, F., and Thompson, J. K., (2002), The Influence of Hydrologic Processes on Reproduction of the Introduced Bivalve Potamocorbula amurensis in northern San Francisco Bay, California, Pac. Sci., 56(3), p329-345.
- Park, H.-S, Lee, J.-H., and Choi, J.-W., (2000), Spatio-temporal Distribution of Macrobenthic Community on Subtidal Area around Mokpo, Korea, J. Korean Soc. Oceanogr.「The Sea」, 5(2), p169-176.
-
Park, S.H., Lee, J.U., Choi, J U., Heo, N.K., and An, H.S., (2016), Study on the Long-term Changes in Water Quality and Benthic Ecology and Evaluation on Effect of the Barrage in Nakdong River Estuary, J. Wetlands Res., 18(1), p58-67.
[https://doi.org/10.17663/jwr.2016.18.1.058]

- Pearson, T.H., Rosenberg, R., (1978), Macrobenthic Succession in Relation to Organic Enrichment and Pollution of the Marine Environment, Oceanogr. Mar. Biol., 16, p229-311.
-
Pielou, E.C., (1966), The Measurement of Diversity in Different Types of Biological Collections, J. Theoret. Biol., 13, p131-144.
[https://doi.org/10.1016/0022-5193(66)90013-0]

- Ryu, J., Khim, J.S., Choi, J.-W., Shin, H.C., An, S., Park, J., Kang, D., Lee, C.-H., Koh, C.-H., (2011a), Environmentally Associated Spatial Changes of a Macrozoobenthic Community in the Saemangeum Tidal Flat, Korea, J. Sea Res., 65, p390-400.
- Ryu, J., Khim, J.S., Kang, S.-G., Kang, D., Lee, C.-H., Koh, C.-H., (2011b), The Impact of Heavy Metal Pollution Gradients in Sediments on Benthic Macrofauna at Population and Community Levels, Environ. Pollut., 159, p2622-2629.
-
Sanchez-Mata, A., Lastra, M., and Mora, J., (1993), Macrobenthic Crustacean Characterization of an Estuarine Area, Crustaceana, 64(3), p337-355.
[https://doi.org/10.1163/156854093x00685]

- Sato, M., (2004), Diversity of Polychaetes and Environments in Tidal Flats: a Study on the Hediste Species Group (Nereididae), Fossils, 76, p122-133.
- Sato., M., and Nakashima, A., (2003), Review of Asian Hediste Species Complex (Nereididae, Polychaeta) with Descriptions of Two Species and a Redescription of Hediste japonica (Izuka, 1908), Zool. J. Linnean Soc., 137, p403-445.
-
Seo, J.-Y., Kim, J.-H., and Choi, J.-W., (2016), Community Structures of Macrozoobenthos in the Subtidal Area of the Nakdong River Estuary, Korea, J. Korean Soc. Oceanogr.「The Sea」, 21(3), p112-124.
[https://doi.org/10.7850/jkso.2016.21.3.112]

-
Seo, J.-Y., Kim, J.-H., and Choi, J.-W., (2017), Spatial Distributions of Macrozoobenthic Commmunities in the Seomjin River Estuary, Ocean Polar Res., 39(1), p23-34.
[https://doi.org/10.4217/opr.2017.39.1.023]

- Suh, S.W., (2004), Hind-casting Simulation of Sedimentation Changes and Passage Hindrance in Keum River Estuary, J. Korean Soc. Coast. Ocean Engineers, 16(4), p224-232.
- Shannon, C.E., and Weaver, W., (1963), The Mathematical Theory of Communication, University of Illinois Press, Urbana, p117.
- Shin, H.C., Choi, J.W., and Koh, C.H., (1989), Faunal Assemblages of Benthic Macrofauna in the Inter- and Subtidal Region of the Inner Kyeonggi Bay, West Coast of Korea, J. Oceanol. Soc. Korea, 24(4), p184-193.
-
Sousa, R., Dias, S., Antunes, J.C., (2006), Spatial Subtidal Macrobenthic Distribution in Relation to Abiotic Conditions in the Lima Estuary, NW of Portugal, Hydrobiol., 559, p135-148.
[https://doi.org/10.1007/s10750-005-1371-2]

-
Thrush, S.F., Pridmore, R.D., Hewitt, J.E., Cummings, V.J., (1992), Adult Infauna as Facilitators of Colonization on Intertidal Sandflats, J. Exp. Mar. Biol. Ecol., 159(2), p253-265.
[https://doi.org/10.1016/0022-0981(92)90040-h]

-
Warwick, R.M., Ashman, C.M., Brown, A.R., Clarke, K.R., Dowell, B., Hart, B., Lewis, R.E., Shillabeer, N., Somerfield, P.J., Tapp, J.F., (2002), Inter-annual Changes in the Biodiversity and Community Structure of the Macrobenthos in Tees Bay and the Tees Estuary, UK, Associated with Local and Regional Environmental Events, Mar. Ecol. Prog. Ser., 234, p1-13.
[https://doi.org/10.3354/meps234001]

- Sung, Y.-J., (2017), Temporal and Spatial Variation in Macrobenthic Community Structure in the Geum River Estuary, M.S. thesis, Anyang University.
-
Yoon, K.-T., Park, H.-S., and Chang, M., (2011), Implication to Ecosystem Assessment from Distribution Pattern of Subtidal Macrobenthic Communities in Nakdong River Estuary, J. Korean Soc. Oceanogr.「The Sea」, 16(4), p246-253.
[https://doi.org/10.7850/jkso.2011.16.4.246]

-
Yoon, S.J., Hong, S., Kwon, B.-O., Ryu, J., Lee, C.-H., Nam, J., and Khim, J.S., (2017), Distributions of Persistent Organic Contaminants in Sediments and Their Potential Impact on Macrobenthic Faunal Community of the Geum River Estuary and Saemangeum Coast, Korea, Chemosphere, 173, p216-226.
[https://doi.org/10.1016/j.chemosphere.2017.01.031]

- Yoon, S.-P., Jung, R.-H., Kim, Y.-J., Kim, S.-G., Choi, M.-K., Lee, W.-C., Oh, H.-T., and Hong, S.-J., (2009), Macrobenthic Community Structure along the Environmental Gradients of Ulsan Bay, Korea, J. Korean Soc. Oceanogr, 「The Sea」, 14(2), p102-117.
-
Ysebaert, T., Meire, P., Herman, P.M.J., and Verbeek, H., (2002), Macrobenthic Species Response Surfaces along Estuarine Gradients: Prediction by Logistic Regression, Mar. Ecol. Prog. Ser., 225, p79-95.
[https://doi.org/10.3354/meps225079]

-
Ysebaert, T., Herman, P.M.J., Meire, P., Craeymeersch, Verbeek, H., and Heip, C.H.R., (2003), Large-scale Spatial Patterns in Estuaries: Estuarine Macrobenthic Communities in the Schelde Estuary, NW Europe, Estuar. Coast. Shelf Sci., 57, p335-355.
[https://doi.org/10.1016/s0272-7714(02)00359-1]

-
Ysebaert, T., Fettweis, M., Meire, P., and Sas, M., (2005), Benthic Variability in Intertidal Soft-sediments in the Mesohaline Part of the Schelde Estuary, Hydrobiol., 540, p197-216.
[https://doi.org/10.1007/s10750-004-7144-5]