Application of the Artificial Mussel for Monitoring Heavy Metal Levels in Seawater of the Coastal Environments, Korea
The new passive sampler called “artificial mussel (AM)” offers a potential device to study the spatiotemporal changes of metal concentrations in different marine environment worldwide. The purpose of this study is to characterize metal (Cd, Cr, Cu, Zn, Pb) accumulation on the AM and transplanted mussel (Mytilus edulis) at 5 sites of Lake Shihwa. Both the AMs and mussels showed increasing concentrations of all five metals during the 12 weeks exposure period. Higher concentrations of Zn were showed in both the AMs and Mytilus edulis relative to other metals. The AMs accumulated higher concentrations of Cd, Cr and Zn, but they presented lower levels of Cu and Pb than Mytilus edulis. The correlations for Cd, Cu and Pb were statistically significant between the AMs and Mytilus edulis, indicating that the accumulation patterns for those metals were similar. However, no similarities for Cr and Zn were observed between two monitoring devices across all of the sites in Shihwa Lake. According to relationship for metal concentrations between dissolve phase in seawater and both the AMs and Mytilus edulis, the AMs for Cd, Cu and Zn represent more metal contamination than Mytilus edulis. Our results indicated that the AMs give a better resolution to reveal the spatial differences in dissolved metal concentration. This study suggests that the AMs can provide a time-integrated estimate of metal pollution in marine environments as well as freshwater environments of Korea.
초록
본 연구에서는 artificial mussel(AM)을 우리나라 해양환경에 처음으로 활용하여 수환경 내 중금속 오염도를 모니터링 하였다. 조사지역으로는 특별관리해역인 시화호 내측 5개 정점을 선정하였으며, AM과 홍합(Mytilus edulis)을 총 12주간 이식실험을 진행함으로써, AM과 홍합 내 지역 및 시간에 따른 중금속(Cd, Cr, Cu, Pb 및 Zn)의 오염도 및 농축특성에 대하여 조사하였다. AM과 홍합 모두 시간에 따라 농도가 증가하였으며, Zn의 축적이 다른 중금속 원소에 비해 높았다. Cd, Cu 및 Pb는 AM과 홍합간 유의한 상관성을 보였으나, Cr과 Zn는 상관성이 없는 것으로 나타났다. 해수 중 용존 중금속과 AM 및 홍합 내 중금속 간의 상관분석결과, Cd, Cu 및 Zn는 홍합보다 AM과 상대적으로 좋은 상관성을 보이고 있는 것으로 나타났다. 12주의 이실실험 후 AM이 홍합에 비해 뚜렷한 지역적 차이를 보이고 있어 해수 중 용존 중금속 농도를 직접적으로 반영하고 있음을 알 수 있었다. 따라서 AM은 우리나라 해양환경의 시·공간적인 중금속 오염도 연구에 모니터링 도구로 사용가능하며, 물리, 화학적인 요인에 적은 영향을 받으므로, 담수를 포함한 다양한 수환경 중금속 오염 연구에 활동도가 매우 높을 것으로 기대된다.
Keywords:
Heavy metal, artificial mussel, transplantation, mussel, Mytilus edulis, pollution, 중금속, 이식, 홍합, 진주담치, 오염1. 서 론
자연적 및 인위적 기원으로 해양으로 유입되는 중금속은 해양환경 내 매우 낮은 농도로 존재하며, 먹이망을 통하여 해양생물 내 축적 되기 때문에(Alibabic et al.[2007]; Burger et al.[2007]; Mason et al.[1995]), 중금속이 축적된 수산자원의 이용은 인간에게 신경성질환 및 암 등의 보건문제를 발생시키고 있다(Becaria et al.[2002]; Grandjean et al.[1997]; Nawrot et al.[2006]; Vinceti et al.[2007]). 인위적인 인간활동에 의한 해양환경 내 중금속 모니터링 및 오염도 평가는 해수, 퇴적물 및 해양생물을 활용하고 있으나, 각각의 한계와 문제점을 가지고 있다.
해수 중 중금속의 경우, 수환경 내 극히 낮은 농도로 존재하기 때문에 시료샘플링과 처리과정에서의 오염원 제거 및 농축 등의 과정들이 필요하며, 시·공간에 따른 변화가 크기 때문에 환경 내 중금속의 오염도 및 장기적인 위해성을 평가하기에는 어려움이 있다 (Philips and Rainbow[1993]; Phillips[1995]). 또한 현재 사용되고 있는 수환경의 중금속 연구는 조사지역을 시기별로 모니터링하는 방법이 주를 이루고 있어 시·공간적인 농도의 분포특성 연구에 더 적합하고 일정기간 축적된 중금속의 오염 평가는 불가능하며 수 환경 내에 존재하는 다양한 형태의 중금속 모두가 생물의 성장 및 생식에 필요하지 않으므로 생물학적 이용가능성에 대한 정보가 제공되지 않는다는 단점이 있다(Phillips and Rainbow[1993]; Phillips[1995]; Rainbow[1990]; Rainbow and Phillips[1993]).
퇴적물 내 중금속은 해수에 비해 축적된 중금속 농도가 매우 높고 장시간 축적되어 있으며 시·공간적인 변화가 작기 때문에 환경내의 중금속 오염도를 평가하는데 매우 유용한 모니터링 도구로 이용되고 있다. 그러나 입자크기, 유기물 함량 및 산화환원상태 등에 영향을 받기 쉬우며 저서생물을 제외한 해양생물에 직접적인 영향보다는 각국에서 설정된 주의기준 및 관리기준 등과의 비교를 통한 간접적인 생물 위해성 평가가 주를 이루고 있다(Calvert[1976]; Phillips and Rainbow[1993]; Ra et al.[2011a]; [2013]; Zabetoglou et al.[2002]).
해양생물 내 중금속은 해수 중 생물이용 가능한 중금속이 장기간 축적되기 때문에 지난 수 십년간 해양환경 내 오염물질 모니터링 연구가 수행되어 왔다. 이동성이 적은 패류를 이용하여 1970년 이후 전세계적으로 Mussel watch program이 시작되었다(Goldberg[1975]; Goldberg et al.[1978]; Lauenstein et al.[1990]; [2002]; O’Connor [2002]; Phillips[1978]; Richardson et al.[1994]). 국제적인 Mussel watch program은 굴이나 홍합을 주로 사용하고 있으며 지역 특성에 따라 이들 패류가 서식하지 않는 지역이 존재하기 때문에 특정 지역 및 국가에 따라 다른 지표종을 선정하여 국제적인 비교연구가 어려운 단점이 존재한다. 우리나라의 경우, 암반이나 구조물에 부착하여 서식하는 굴이나 홍합을 이용하여 간헐적인 모니터링이 시행되어 왔다(Choi et al.[1992]). 그러나 서해안과 남해안과 같이 조간대에 널리 갯벌이 존재하는 경우, 굴이나 홍합의 분포가 제한되어 해양환경 전반의 오염현황을 파악하는데 한계가 존재하며 우리나라 전 해안지역에 널리 서식하는 바지락을 활용하기도 한다(Ahn et al.[2006]; Ra et al.[2011b]). 무엇보다 지표생물을 이용한 해양환경내 중금속 오염 연구는 물리적(수온, 염분) 및 생물학적 요인(크기, 생식단계, 나이, 성별)에 의하여 큰 영향을 받는 것으로 널리 알려져있다(Leung et al.[2001]; [2002]; Phillips and Rainbow[1993]; Wu and Lau[1996]). 또한 성숙단계, 영양상태, 계절, 축적 및 배설 등에 따라 체내 중금속 농도가 영향을 받기 때문에 개체간 큰 폭의 중금속 농도차이가 존재하며(Cacas and Bacher[2006]; Luoma and Rainbow[2005]; Paez-Osuma et al.[1995]; Rainbow[2007]; Wang et al.[1995]), 필수원소인 구리나 아연은 대부분의 지표생물 자체가 농도를 조절하기도 한다(Philips and Rainbow[1993]; Yap et al.[2003]).
Artificial mussel(이하 AM)은 해양생물을 활용한 biomonitoring의 문제점을 해결하기 위하여 2007년 Wu et al.[2007]에 의해 개발되었으며, 플라스틱 튜브에 중금속 자유 이온과 복합체가 투과가능한 polyacrylamide gel, 인공해수 및 Chelex-100으로 이루어져 있다. Chelex-100은 다원자 금속이온과 킬레이트를 이루는 특성을 가지므로 수 환경 내 생물이용가능한 중금속(Cd, Cr, Cu, Pb, Zn) 연구가 가능한 것이 장점이며, 수온 및 염분에 의한 영향이 적기 때문에 강, 하천, 지하수, 해수 등에 다양한 수 환경에서 적용되고 있다. 따라서 Artificial Mussel Watch Program은 홍콩(Wu et al.[2007]), 스코틀랜드(Leung et al.[2008]), 남아프리카(Degger et al.[2011]), 포르투갈(Gonzalez-Rey et al.[2011]) 및 호주(Kibria et al.[2012]) 등의 국가에서 최근 진행되기 시작하여 국제적인 비교가 가능하게 되었다.
본 연구에서는 AM을 우리나라 해양환경 내 중금속 연구에 처음으로 활용하였으며, 홍합(Mytilus edulis)의 이식실험을 함께 진행하여 특별관리해역인 시화호에서 해수 중 중금속(Cd, Cr, Cu, Pb, Zn) 오염의 시·공간적 변화 및 각각의 중금속 원소 농축특성에 대하여 조사하였다.
2. 재료 및 방법
2.1. Artificial mussel
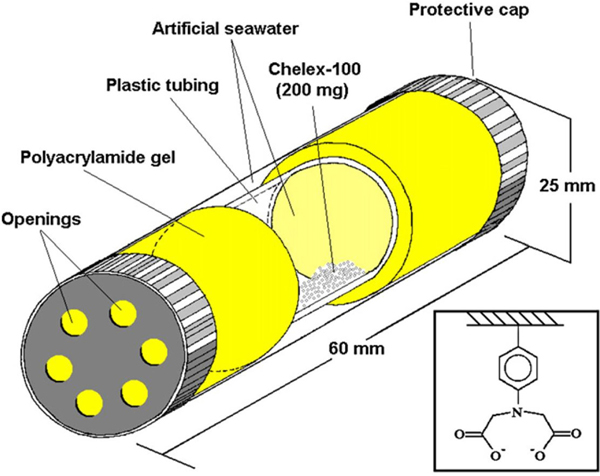
AM 패시브 샘플러(passive sampler)는 흡수제 매질의 확산장벽을 통해 금속을 축적시키기 위한 기구로, 비투과성의 Perspex tubing (60mm × 25 mm) 내측에 약 200mg의 Chelex-100 resin(50-100 mesh, Bio-Rad), 8 mL의 인공해수를 주입하고 양측에 1 cm 두께에 투과 가능한 polyacrylamide gel로 구성되어 있다(Fig. 1). Polyacrylamide gel은 해수의 확산율에 따라 금속원소의 흡수율을 조절하고, 이를 통과한 해수 내 금속을 Chelex-100 resin이 금속착물을 형성하여 해수 중 금속을 농축시키는 특징을 가지고 있다.
2.2. 실험 디자인
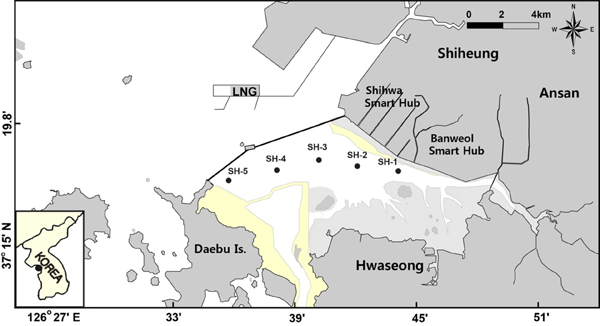
AM(n=125)은 플라스틱 바구니에 케이블 타이를 이용하여 고정 시켰으며, 홍합(n=125)을 함께 1m 수심의 시화호 내측 5개 정점의 표층수에 총 12주간 이식실험을 진행하였다(Fig. 2). 이식실험에 사용한 홍합은 시화호 외측에서 채취하여 7일동안 여과된 해수를 사용하여 depuration 시켜 사용하였고, 개체(크기)에 따른 농도차이를 최소화 하기 위하여 유사한 크기(평균 각장 72.0±2.6 mm; N=125)만을 선별하였다. AM과 홍합은 2주, 4주, 8주 및 12주에 각각 6개체씩 채취하였다. AM은 현장 해수로 적신 타올로 감싼 뒤 플라스틱 bag에 넣어 분석시까지 건조가 되지 않도록 보관하였다. 홍합은 족사(byssus)를 제거한 뒤 현장에서 각장과 무게를 측정하였으며, 오염되지 않게 플라스틱 칼을 이용하여 연질부만을 분리하였고 지퍼백에 담아 냉동보관 후 동결건조(Labconco Freezone 6, USA)를 실시 하였다. 홍합 각 개체는 자동분쇄기(Pulverisette 6, Fritsch Co. Germany)로 분쇄 및 균질화하였으며 분석시까지 산 세척된 폴리에 틸렌 시료병에 넣어 보관하였다. 정점에 따른 용존 증금속의 농도차이를 비교하기 위하여, AM과 홍합을 투입하고 회수한 시기에 미리 산으로 세척된 500 mL LDPE 시료병을 PVC 막대에 매달아 표층수를 함께 채수하였다(Boyle et al.[1981]). 해수 시료는 청정벤치(clean bench) 내에서 산세척한 polycarbonate 막여과지(Whatman, 0.4 mm poresize)로 여과한 뒤 질산(ultrapur)을 가하여 pH 2 이하로 처리하여 분석시까지 보관하였다.
2.3. 중금속 분석
홍합 내 중금속 분석은 분쇄된 시료 약 0.1 g을 테프론 digestion bomb에 넣고 질산(suprapur, Merck Co., Germany)을 가한 뒤 가열판(hot plate)에서 24시간 동안 180 oC로 가열하였다. 시료가 완전분해된 후 증발건고 시켰으며 1% 질산으로 재용해시켜 ICPMS(Thermo Elemental X-7)로 중금속(Cd, Cr, Cu, Pb 및 Zn)을 분석하였다. 홍합 내 중금속 결과는 건중량(mg/g dry weight)으로 표현하였다. 분석된 홍합 중금속 데이터의 정확도를 검증하기 위하여 홍합 표준물질인 SRM-2976(National Institute of Standard and Technology, USA)를 시료와 동일한 방법으로 분석하였으며 보증값에 대한 회수율(%)은 96.7(Zn)~100.0(Cd)로 매우 양호한 결과를 얻었다(Table 1).
AM 내 중금속은 내부에 Chelex-100이 손실되지 않도록 산세척된 여과지 위로 옮긴 후 Milli-Q로 3회 세척하였고 Chelex-100 표면에 흡착되어 있는 중금속을 6M 질산(suprapur, Merck Co., Germany) 10 mL를 넣어 침출 시킨 후 여과하는 과정을 2회 반복하여 추출하였다. 추출된 중금속은 테프론 vial에서 증발건고 후 1% 질산으로 재용해시켜 ICP-MS로 분석하였으며 AM 내 중금속 농도는 Chelex resin에 대한 건중량(mg/g Chelex)으로 표현하였다.
해수 중 용존 미량금속(Cd, Cu, Pb, Zn)은 청정벤치에서 시료를 APDC-DDTC-Freon(HCHC-141b)용매추출법으로 추출한 뒤(Statham [1985]), ICP-MS로 분석하였다. 용존 중금속 분석의 정확도를 검증하기 위하여 해수 표준물질은 CASS-5를 같은 방법으로 분석하였으며 매우 좋은 회수율을 보였다(Table 1).
AM과 홍합 내 중금속 항목 결과간의 개별적인 상관관계를 파악하기 위하여 상관분석(Pearson’s correlation)을, 지역간의 농도차이를 비교하기 위하여 투키(Tukey) 검정법에 의한 분산분석(one-way analysis of variance; ANOVA)을 실시하였다. 모든 통계분석은 SPSS(version 18.0, Chicago, USA)를 통해 수행되었다.
3. 결과 및 토의
3.1. 시간에 따른 중금속 농축 특성
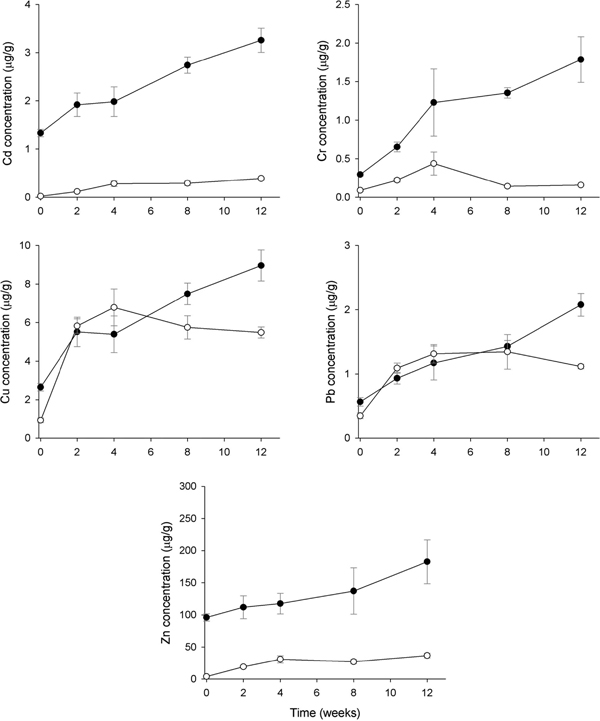
시화호 상류지역으로 반월 스마트 허브에 인접하며 신길천 등 하천을 통한 중금속 오염의 영향을 직접적으로 받고 있는 정점 1에서 홍합 내 Cd은 1.33 μg/g에서 4주까지만 2.73 μg/g으로 농도가 증가 하였으며 8주 이후에는 4주와 유사한 농도를 보였다(Fig. 3). AM 내 Cd은 홍합에 비해서 농도의 증가 폭은 적으나 이식 시간이 경과할수록 지속적으로 농도가 증가하고 있었다. 홍합 내 Cr은 12주 동안 0.30 μg/g에서 3.01 μg/g으로 10배 농도가 증가하였으나, AM 내 Cr은 2주까지만 농도가 증가한 뒤 일정한 농도를 유지하고 있었다(Fig. 3). Cd와 Cr은 모든 조사시기에서 홍합이 AM에 비해 높은 농도를 보였으나, Cu는 AM의 농도가 홍합보다 높은 농축특성을 보였다. 홍합 내 Cu는 12주까지 꾸준히 농도가 증가하여 초기에 비해 7.5배 농도가 증가하였다. AM 내 Cu는 초기 0.93 μg/g에서 8주 후 34.36 μg/g으로 45배 농도가 증가한 뒤 12주에는 약간 감소하고 있었다. 홍합 내 Pb는 샘플링 시기에 따라 농도의 증가 폭은 다르게 나타났으나 초기 0.57 μg/g에서 12주 후 2.84 μg/g으로 5배 농도가 증가하였다. 그러나 AM 내 Pb는 0.35 μg/g에서 2주까지만 큰 폭으로 농도가 증가하였으며 이후 일정한 농도를 유지하고 있었다. 홍합 내 Zn는 초기 95.9 μg/g에서 4주까지 186.7 μg/g으로 2배 농도가 증가한 뒤 감소하는 시간 변화 특성을 보였다. AM 내 Zn는 모든 조사시기에서 지속적으로 농도가 증가하여 12주에는 195.4 μg/g으로 초기 3.91 μg/g에 비해 50배 농도가 증가하였다. Zn의 경우, 4주까지는 홍합과 AM이 같은 증가율을 보였으나, 이후 AM의 농도는 계속 증가한 반면 홍합은 감소하였다(Fig. 3).
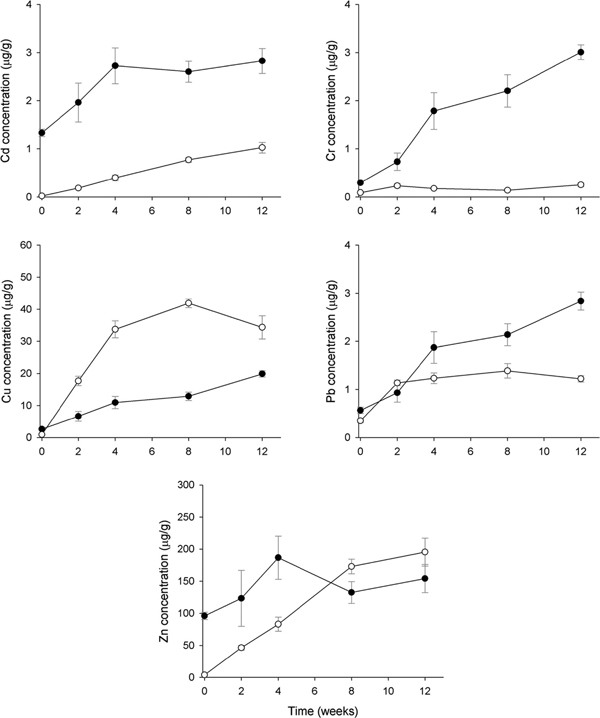
Temporal patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis (closed circle) and artificial mussels (open circle) deployed in SH-2 of Shihwa Lake. All concentrations are presented as mg/g dry mass for transplanted mussel and mg/g Chelex for the AMs.
시화 스마트 허브와 인접한 정점 2에서 홍합 내 Cd은 8주까지 급격히 농도가 증가하여 3.60 μg/g의 최대농도를 보인 뒤 감소하였다. 그러나 12주 후 3.43 μg/g의 농도를 나타내 정점 1에서의 2.82 μg/g 보다 높은 Cd 농축도를 나타냈다. AM 내 Cd은 이식실험 기간 증가에 따라 지속적으로 농도가 증가하였으나, 증가폭은 홍합에 비해 작았으며, 12주 후 0.40 μg/g의 농도로 정점 1에서의 12주 후 농도와 비교하면 40%에 불과하였다(Fig. 4). 홍합 내 Cr은 4주까지는 농도의 증가폭이 작다가 이후 급격한 농도의 증가를 보였으나, AM은 4주까지 증가하다가 이후 일정한 농도를 유지하고 있었다. 정점 2에서 12주 후 Cr 농도는 0.29 μg/g으로 정점 1의 0.25 μg/g에 비해 약간 높았다(Fig. 4). 정점 1과 마찬가지로 모든 조사시기에서 홍합 내의 Cd와 Cr 농도가 AM에 비해 높았다. Cu의 경우, 2주에서 8주까지는 AM이 홍합에 비해 상대적으로 높은 농도를 보였으나 12주에는 홍합이 AM에 비해 높은 농도를 보이고 있었다. 홍합에서는 2주에서 4주 사이 약간 감소한 것을 제외하고는 전반적으로 시간에 따라 Cu 농도가 증가하였으나, AM은 2주까지만 급격히 농도가 증가한 후 증가폭은 감소하는 특징을 보였다. 홍합 내 Pb는 4주까지는 농도의 증가폭이 작았으나 이후 급격히 증가하여 12주에는 2.47 μg/g로 초기(0.57 μg/g)에 비해 4.3배 농도가 증가하였다. 그러나 AM내 Pb는 2주까지만 농도가 급증하였고 이후 증가폭은 확연히 감소하는 것으로 나타났다. 따라서 2주와 4주에서 Pb 농도는 AM이 홍합이 비해 높았으나, 8주 이후에는 홍합의 농도가 상대적으로 높은 결과를 보였다. Zn의 경우, 모든 조사시기에서 홍합 내 농도가 AM에 비해 높았으며 다른 중금속 원소와 유사하게 이식실험 초기에는 농도의 증가폭이 작다가 4주 이후 농도가 급증하고 있었다. AM 내 Zn는 정점2에서 12주 후 49.1 μg/g으로 정점 1(195.4 μg/g )의 1/4수준의 낮은 농도를 보였다(Fig. 4).
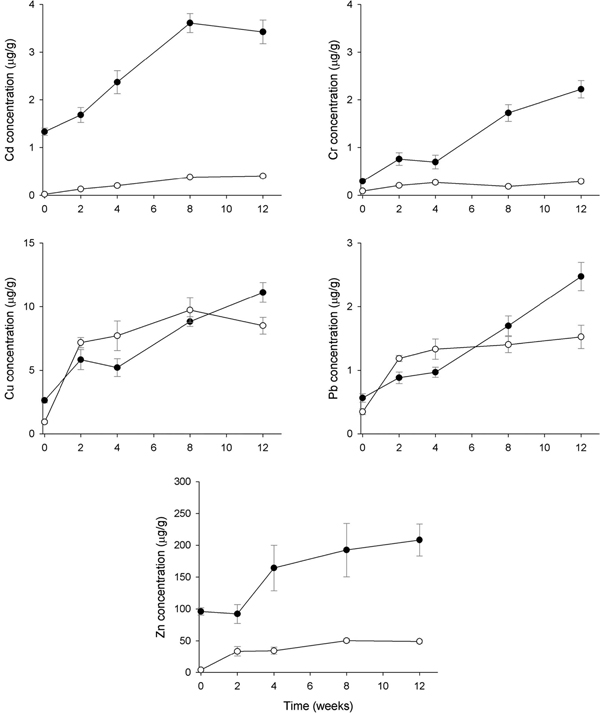
Temporal patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis (closed circle) and artificial mussels (open circle) deployed in SH-2 of Shihwa Lake. All concentrations are presented as mg/g dry mass for transplanted mussel and mg/g Chelex for the AMs.
시화호의 중앙부에 위치하였으며 산업시설을 통한 중금속 오염과 조력발전소 가동으로 인한 외해수 유입의 복합적인 영향을 받고 있는 정점 3에서 시간에 따른 중금속 농도 변화는 Fig. 5에 나타냈다. 홍합 내 Cd은 초기에서 4주까지는 농도의 증가폭이 작았으나 이후 농도가 급격히 증가하여 12주 후에는 3.26 μg/g으로 정점 2와 유사한 결과를 보였다. AM 내 Cd은 이식실험 4주까지는 0.02 μg/g에서 0.28 μg/g으로 큰 폭으로 농도가 증가하였으나 이후 농도의 증가폭은 감소하여 홍합과 반대되는 농축특성을 보였다. 홍합 내 Cr은 Cd와는 다르게 4주까지는 농도가 급격히 증가하였으나 이후 농도의 증가폭이 감소하였다. 12주 이식실험 후 정점 3에서의 홍합 내 Cr 농도는 1.78 μg/g으로 정점 1의 3.01 μg/g, 정점 2의 2.22 μg/g에 비해 낮아져, 시화호 상류지역에서 중앙부로 갈수록 체내 Cr 축적이 감소한 것을 알 수 있었다. AM 내 Cr은 4주까지만 농도가 증가하였으나, 이후 홍합과는 다르게 농도가 급격히 감소하였다. Cu의 경우, 이전 정점과 마찬가지로 이식 실험 초기에는 AM이 홍합에 비해 높은 농도를 보였으나, 이후 AM은 농도가 감소한 반면 홍합은 지속적으로 농도가 증가하고 있어, 홍합에서의 농도가 AM을 초과하고 있었다(Fig. 5). 홍합 내 Pb는 12주까지 지속적으로 농도가 증가하였으나, AM은 4주까지만 급격히 농도가 증가한 뒤 감소하는 Cu와 유사한 시간에 따른 변화특성을 보였다. 홍합과 AM 모두 시간에 따라 Zn 농도가 완만하게 증가하는 경향을 보이고 있었으며, 앞선 정점과 마찬가지로 홍합이 AM에 비해 높은 농도를 보였다. 12주 후 홍합과 AM 내 Zn 농도는 각각 182.7 μg/g과 36.7 μg/g으로 홍합은 정점 1보다 높았으나 AM은 정점 1보다 낮은 농도를 보였다.
Temporal patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis (closed circle) and artificial mussels (open circle) deployed in SH-3 of Shihwa Lake. All concentrations are presented as mg/g dry mass for transplanted mussel and mg/g Chelex for the AMs.
조력발전소에 인접하여 외해수 유입의 영향을 많이 받고 있는 정점 4에서 홍합 내 Cd, Cr, Cu 및 Zn는 모든 조사시기에서 AM에 비해 높은 농도를 보였다(Fig. 6). 홍합에서는 급격히 Cd 농도가 증가하였으나, AM은 시간에 따른 Cd 농도의 증가경향은 있으나 증가폭은 작았다. 홍합 내 Cr은 12주까지 지속적으로 농도가 증가하고 있었으나, AM 내 Cr은 2주까지만 농도가 증가한 뒤 감소하고 있었다. 시화호 상류와 중앙지역인 정점 1-3에서 Cu는 이식실험 초기(~4주까지)에 AM이 홍합에 비해 높은 농도를 보였으나, 정점 4에서는 모든 조사시기에서 홍합의 농도가 더 높았다(Fig. 6). AM 내 Cu는 정점 3과 마찬가지로 초기에서 2주까지만 농도가 급격히 증가하였고 이후 일정한 농도를 보이고 있었다. Pb의 경우, 4주까지는 AM이 홍합에 비해 높은 농도를 나타내었으나 8주 이후 홍합은 농도가 지속적으로 증가한 반면 AM은 증가폭이 감소한 것으로 나타났다(Fig. 6). 홍합 내 Zn는 이식실험 경과에 따라 지속적으로 농도가 증가하여 12주 후 95.9 μg/g에서 189.3 μg/g으로 2배 농도가 증가하였으나, AM은 4주까지만 증가한 뒤 이후 감소한 결과를 보였다.
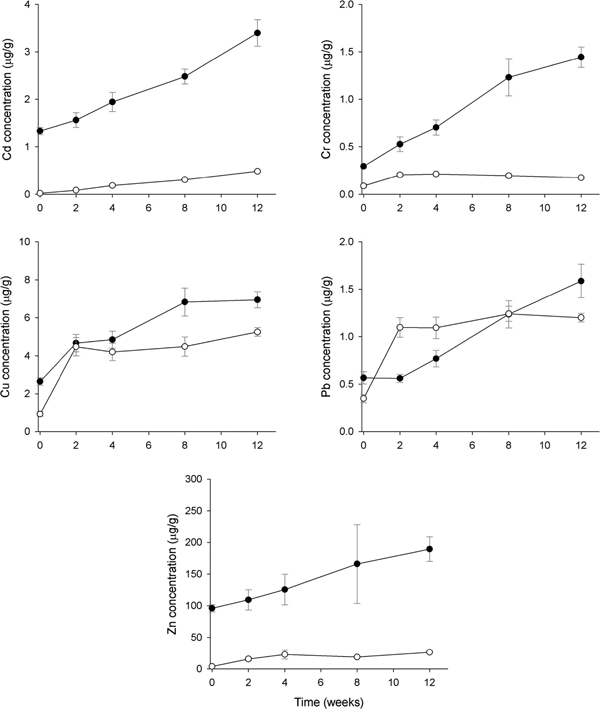
Temporal patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis (closed circle) and artificial mussels (open circle) deployed in SH-4 of Shihwa Lake. All concentrations are presented as mg/g dry mass for transplanted mussel and mg/g Chelex for the AMs.
시화호 배수갑문 인접하여 다른 정점들에 비해 중금속 오염도가 상대적으로 적은 정점 5에서, 홍합 내 Cd는 초기 1.33 μg/g에서 2주1.68 μg/g, 4주 2.73 μg/g으로 4주까지 2배 농도가 큰 증가한 뒤 8주와 12주는 2.79 μg/g와 2.88 μg/g로 더 이상의 체내 축적을 보이지 않았다(Fig. 7). AM 내 Cd는 홍합에 비해 농도의 증가폭이 크지는 않으나, 12주까지 점차적으로 농도가 증가하고 있었다. 홍합 내 Cr은 4주까지는 농도가 약간씩 증가하였으나 4주 이후 급격히 증가하였다. 그러나 AM 내 Cr은 4주까지만 농도가 증가한 뒤 이후 감소하고 있었다. Cu는 홍합과 AM 모두 이식실험시간 증가에 따라 체내 농도가 증가하는 경향을 보였으며, 홍합 체내의 Cu 농도가 AM에 비해 약간 높았다. 홍합 내 Pb는 4주까지 증가 폭이 작았으나 이후 큰 폭으로 농도가 증가하여 12주 1.63 μg/g으로 초기 0.57 μg/g에 비해 약 3배 높은 농도를 보였다. 그러나 AM은 2주까지만 Pb의 농도가 큰 폭으로 증가한 뒤 이후 일정한 농도를 유지하고 있었다. Zn의 경우, 홍합과 AM 모두 시간에 따라 농도가 지속적으로 증가하고 있으나 12주의 농도가 20.9 μg/g으로 홍합 189.3 μg/g(12주)에 비해 매우 낮은 농축을 보였다.
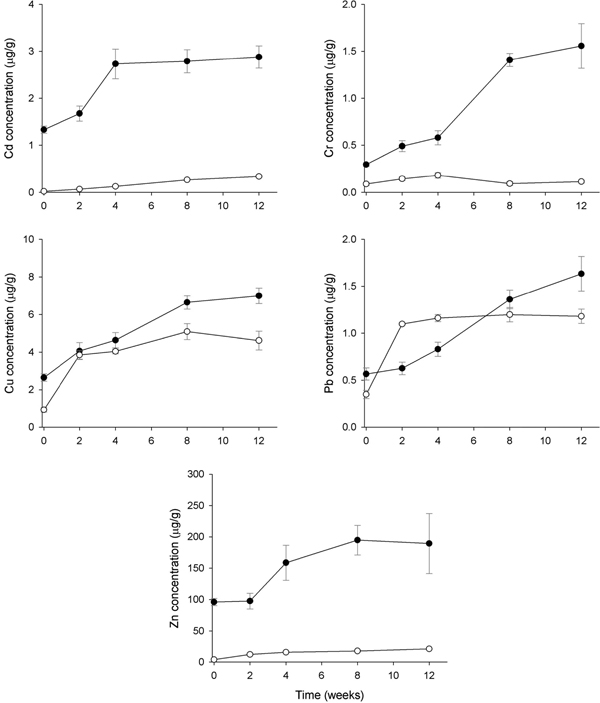
Temporal patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis (closed circle) and artificial mussels (open circle) deployed in SH-5 of Shihwa Lake. All concentrations are presented as mg/g dry mass for transplanted mussel and mg/g Chelex for the AMs.
AM의 구성물질인 semi-permeable polyacrylamide gel은 Cd2+, Cr3+, Cu2+, Pb2+, Zn2+의 자유이온 형태 뿐만 아니라 복합물(complexes)도 투과 가능하며, 이들 중금속 원소는 대부분 생물이 이용하거나 독성을 나타내는 것으로 보고되었다(Iyer and Sarin[1992]; Phillips and Rainbow[1993]). Polyacrylamide gel을 통과한 금속 이온은 Chelex-100 resin 흡착하는 특성으로 인하여, 시화호 내측 해수 중의 중금속(Cd, Cr, Cu, Pb, Zn)이 12주간의 이식실험 기간 동안 꾸준히 AM 내 축적되는 경향을 보이고 있었다(Fig. 3~Fig. 7). 시화호 정점 1에서 AM과 홍합 내 중금속 농도는 다른 정점에 비해 높았으며 농도의 증가폭 역시 가파르게 나타났다. Cd와 Cr은 모든 조사 정점에서 홍합 내 농도가 AM에 비해 높은 결과를 보이고 있었다. Cu의 경우, 오염원인 반월 및 시화 스마트허브에 인접한 정점 1에서 AM 내 큰 폭으로 농도가 증가하여 홍합보다 높은 농도를 보이고 있었으나, 오염원에서 멀어질수록 홍합 내 농도가 AM을 초과하고 있었다. Pb는 정점 및 이식시간에 따라 농도차이는 있으나 다른 중금속 원소와 유사하게 AM과 홍합간에 뚜렷한 농도차이를 보이지 않았다. 이식실험 초기인 4주까지는 AM이 홍합에 비해 상대적으로 높은 농도를 보였으나 이후에는 홍합 내 Pb 농도가 오히려 높은 결과를 나타내고 있었다. Zn의 경우, 오염원에 가까운 정점 1의 이식실험 초기(~4주)를 제외하고는 홍합이 AM에 비해 높은 농도를 보였다. 그러나 4주 이후에는 홍합 내 Zn 농도가 더 이상 증가하지 않고 있었다. 이러한 결과는 홍콩, 빅토리아 항에서의 연구결과와 유사하였으며(Wu et al.[2007]), 이는 홍합 자체에 축적된 Zn가 어느 수준 이상으로 증가하면 자체적으로 조절하고 있기 때문으로 판단된다.
3.2. 지역에 따른 중금속 농축 특성
12주 이식실험 후 정점에 따른 홍합과 AM 내 중금속 농도 비교는 Fig. 8에 나타냈다. 홍합 내 Cd은, 정점 2에서 3.43 μg/g으로 최대농도를 보였으며 정점 1에서 2.82 μg/g으로 최소농도를 나타냈으나, 정점간 통계학적으로 유의한 차이를 보이지 않았다. AM 내 Cd은 산업시설에 가까운 정점 1에서 1.02 μg/g의 최대농도를 보였으며, 배수갑문에 가까운 정점 5에서 0.34 μg/g의 최소농도를 보여 정점에 따라 3배의 농도차이를 보였다. Tukey 검정법에 의한 분산분석(ANOVA) 결과, 정점 1이 다른 정점과는 유의한 농도차이를 보이는 것으로 나타났다(p<0.01). Cr의 경우, 홍합은 정점 1에서 최대 농도인 3.01 μg/g을 나타내 다른 정점에 비해 유의한 농도차이를 보였으며, 배수갑문 인근인 정점 5에서는 절반수준인 1.56 μg/g으로 농도가 감소하여, 시화호 상류지역에서 배수갑문으로 갈수록 농도가 감소하고 있었다. AM 내 Cr은 정점 2에서 0.29 μg/g의 최대농도를, 정점 5에서 0.11 μg/g의 최소농도를 나타내고 있어 정점에 따라 2.6배의 농도차이를 보였다. 특히 반월 및 시화 스마트 허브인 산업시설에서 가까운 정점 1과 2는 다른 정점에 비해 유의한 수준으로 높은 Cr 농도를 나타내고 있었으며, 홍합과 AM 모두 정점에 따른 뚜렷한 차이를 나타냈다(p<0.01).
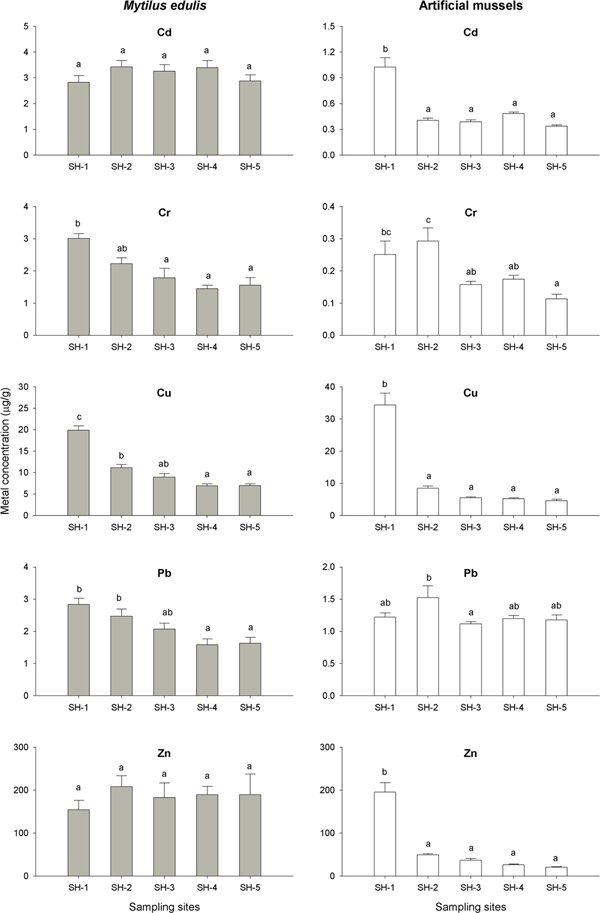
Spatial patterns of metal accumulation (mean±SEM) in the transplanted Mytilus edulis and artificial mussels at 5 sites of Shihwa Lake after 12 weeks. Bars with the same letter are statistically indifferent (one-way ANOVA and Tukey tests).
Cu는 홍합과 AM 모두 오염원에서 가까운 정점 1에서 각각 19.9μg/g와 34.4 μg/g의 최대농도를 보였으며 다른 조사정점들과 유의한 농도차이를 나타냈다(p<0.01). Cr와 마찬가지로 홍합과 AM 내 Cu는 배수갑문으로 갈수록 농도가 감소하는 공간분포 특성을 나타내고 있었다. Pb 역시 Cu와 마찬가지로 홍합에서는 정점 1이 2.84 μg/g, 정점 2가 2.47 μg/g으로 다른 정점들에 비해 높은 농도를 보였다(p<0.01). AM 내 Pb는 정점 2에서 1.52 μg/g의 최대농도를 보였으며 나머지 조사지역은 유사한 농도를 나타내고 있었다. 홍합과 AM 내 Pb는 정점에 따라 각각 1.7배와 1.3배의 농도차이를 보였으나, 홍합만이 산업단지 인근에서 높은 농도를 보이고(p<0.01), 배수갑문으로 갈수록 농도가 감소하는 경향을 보였다. 홍합 내 Zn는 정점에 따른 유의한 농도차이가 없었으며, Cd와 마찬가지로 오염원에서 가까운 정점 1에서 최소농도를 나타내고 있었다. AM은 정점 1에서 195.4 μg/g의 Zn 농도를 보여 Cd 및 Cu와 마찬가지로 반월 및 시화 스마트 허브의 대규모 산업시설에 인접한 정점이 다른 지역에 비해 유의하게 높은 농도를 보이고 있었다(Fig. 8). 중금속 오염원에서 가까운 정점 1에서 12주의 이식실험 후 홍합과 AM 내 중금속 농도를 단위시간당 축적량으로 계산한 결과, Cu와 Zn는 AM이 각각 0.398 μg/g/day와 2.280 μg/g/day로 홍합의 0.205 μg/g/day와 0.694 μg/g/day에 비해 상대적으로 높은 결과를 보였다. 그러나 Cd, Cr, Pb는 홍합에서의 축적이 각각 0.018 μg/g/day, 0.027 μg/g/day, 0.032 μg/g/day로 AM에 비해 높았다. 단위시간당 축적량은 홍합이 Zn>Cu>Cr>Pb>Cd의 순이었으며, AM은 Zn>Cu>Cd>Pb>Cr로 나타나, 홍합과 AM 모두 Zn의 시간당 축적이 가장 높았다.
본 연구에서 홍합과 AM내 중금속 원소간의 상관성 분석결과는 Table 2에 나타냈다. Cd는 홍합과 AM간 농도차이는 컸으나 시간에 따른 변화 특성이 유사하게 나타났기 때문에 양호한 양(+)의 상관성을 보이고 있었다(r=0.577, p<0.01). Cr은 홍합과 AM간의 상관성은 없었으며 (r=0.098), 이는 홍합은 시간 변화에 따라 지속적으로 농도가 증가하였으나 AM은 2주 혹은 4주 이후 오히려 농도가 감소하였기 때문이다. Cu는 정점 1에서 AM 내 Cu 농도가 홍합에 비해 높았으며, 나머지 정점에서는 홍합이 AM보다 높은 농도를 보이는 특징을 보였으나 상호간에는 좋은 상관성을 보였다(r=0.790, p<0.01). Pb는 Cd 및 Cu와 마찬가지로 홍합과 AM간에 좋은 상관성을 나타내고 있었다(r=0.512, p<0.05). Zn는 Cr과 유사하게 홍합과 AM간에 상관관계가 없는 것으로 나타났다. AM 내 Cd는 Cu, Pb 및 Zn와 양호한 상관성을 보이고 있었으나(p<0.05), Cr과는 상관성이 없는 것으로 나타났다. 그러나, 홍합 내 중금속 원소간에는 양호한 상관성을 보이고 있었다(p<0.01).
시화호 내 정점에 따른 해수 중 용존 중금속의 평균농도는 Table 3에 나타냈다. Cd는 정점 1에서 0.080 μg/L의 최대농도로 최소농도를 보인 정점 4에 비해 1.8배 높은 농도를 보였으나, 통계학적으로 유의한 차이는 없었다. Cu는 정점 1에서 5.27 μg/L의 최대농도로 다른 정점과는 유의한 농도차이를 보였다(p<0.01). 해수 중 용존 Cu농도는 배수갑문으로 갈수록 농도가 감소하는 공간적인 분포 특성을 보였다. 이러한 공간적인 분포 특성은 홍합과 AM 내 Cu에서도 나타났으며, 해수 중의 용존 Cu이 홍합과 AM에 축적되었기 때문으로 판단된다. 용존 Pb 역시 다른 중금속 원소와 마찬가지로 오염원에 인접한 정점 1에서 0.13 μg/L의 최대농도를 보였으나, 지역에 따른 유의한 차이는 없었다(Table 3). Zn는 Cu와 마찬가지로 정점 1이 17.20 μg/L의 농도로 다른 정점들과 유의한 수준의 농도차이가 있는 것으로 나타났다(p<0.01). Fig. 9에서는 해수 중 용존 중금속과 홍합 및 AM 내 축적된 중금속 농도(12주 이식실험 후)간의 상관성을 나타냈다. AM은 Cd, Cu 및 Zn 가 용존 상태와 양호한 양(+)의 상관성을 나타내었다. 홍합은 Cu와 Pb만이 용존 중금속 농도와 양호한 상관성을 나타내고 있었다. 홍합 내 Cd는 용존 중금속 농도와 상관성이 없는 것으로 나타나, 조사해역의 용존 중금속 농도가 홍합의 축적의 영향을 거의 주지 못하며, 용존 중금속 보다는 먹이원인 입자성 부유물질을 통한 축적이 된 것으로 판단된다. 또한 홍합 내 Zn는 해수 농도 증가시에 오히려 홍합 내 Zn 농도가 감소하고 있어, 체내 축적 보다는 배출이 이루어 지고 있는 것으로 생각된다.

Correlation factor among heavy metals of the artificial mussel (AM) and Mytilus edulis (ME) in the present study by Pearson’s correlation analysis

Mean of dissolved metal concentrations in seawater of Shihwa Lake, Korea (N=5). Superscripts with the same letter are statistically indifferent (one-way ANOVA and Tukey tests)
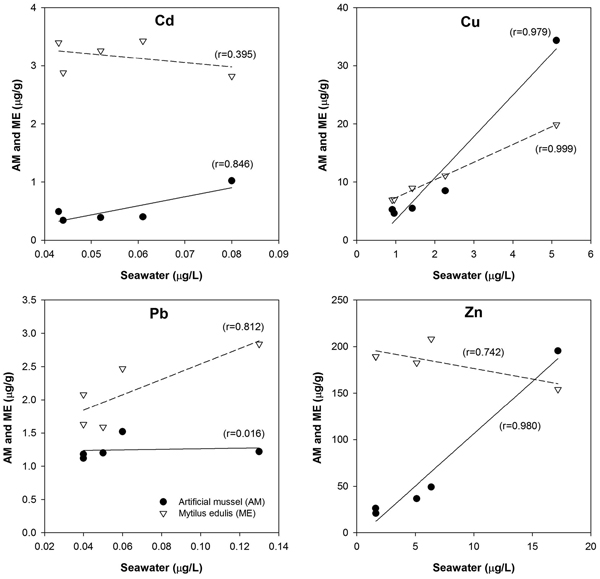
Correlation of metals (Cd, Cu, Pb and Zn) for 5 sites between the mean of dissolved concentrations in seawater and both the artificial mussel and Mytilus edulis concentrations collected at 12 weeks. The r values were classified as follows: 0.60-1.0=strong correlation, 0.50-0.59=moderate, 0.40-0.49=weak, 0.00-0.39=no association.
홍합(Mytilus edulis)은 해수 내 용존 상태와 가용먹이원인 부유물질 내 중금속을 축적하지만, 홍합 내 중금속의 순 축적은 두 가지 오염원에 중금속의 배출 및 조절이 포함된 것이다(Wang et al.[1995]). 특히 자연에 서식하는 홍합은, 늦은 봄에서 여름까지의 산란시기에 지방함량이 감소하기 때문에 체내 중금속 농도 역시 감소하며 물리적(수온, 염분, 부착기질)과 생물학적 요인(생물종, 연령, 사이즈, 기관 및 성장단계)에 따라 중금속 농도의 큰 차이가 존재한다(Fisher[1986]; Rainbow and Phillips[1993]; Leung et al.[2001]; Wang and Fisher [1997]). 홍합 등 해양생물을 이용한 중금속 연구는 농도에 영향을 미치는 다양한 요인들을 표준화 하여 시·공간적인 차이를 직접적으로 비교하는 것이 불가능하고 핫스팟(Hot spot) 존재시 개체가 사망 할 수도 있으므로 지속적인 영향에 대한 연구는 어렵다. 또한 해양환경 내 중금속 오염이 우려되는 해역에 홍합이 서식하지 않으면 농도 비교가 어려우며, 예를 들면 Mussel Watch program에서 북미와 남미 연안의 76개 조사지역 내 오염물질 모니터링에서는 약 25종의 다른 패류를 조사하였다고 보고된 바 있다(Sericano et al.[1995]). 대부분의 해양환경 모니터링의 주요한 목적은 시·공간에 따른 오염 물질의 변화를 해양생물에 독성영향을 미치기 이전에 파악하는 것이다. AM은 가장 독성이 있는 자유이온 상태의 중금속만을 축적하며 시간에 따른 중금속 오염에 대한 누적된 정보를 제공하기 때문에 해양생물을 이용한 모니터링에 상호보완적인 정보를 제공하여, 지형학적, 물리적 및 생물학적인 영향이 적기 때문에 전세계 해양 및 연안 환경에서의 중금속 오염도 모니터링에 보다 적합하다. 본 연구결과 역시 AM이 자연적인 홍합에 비해 중금속 오염에 대한 확실한 지역적 차이와 해수 중 용존 형태의 중금속과 보다 높은 상관성을 보이고 있는 것으로 나타났다. AM은 염분구배가 발생하는 하구역 및 지형학적 특성이 다른 연안 지역과 같은 해양환경에 적용이 가능할 뿐 만 아니라 담수 환경에서도 사용가능하기 때문에 우리나라 수환경 중금속 연구에 중요한 역할을 할 것으로 판단된다.
4. 요 약
패시브 샘플러인 artificial mussel(AM)은 패류를 이용한 바이오모니터링(bio-monitoring)의 문제점을 해결하기 위하여 2007년 Wu et al.[2007]에 의해 개발되었으며, 전세계적으로 다양한 환경 내 중금속 오염도 모니터링을 위한 도구로 활용되기 시작하였다. 본 연구에서는 AM을 우리나라 해양환경 내 중금속 모니터링에 처음으로 활용하였으며, 특별관리 해역인 시화호 내 5개 정점에서 12주간 홍합(Mytilus edulis)과 함께 이식실험을 진행함으로써 해수 중 중금속(Cd, Cr, Cu, Zn 및 Pb) 오염도를 평가 및 시·공간에 따른 중금속 농축 특성에 대하여 조사하였다. AM과 홍합 모두 12주간의 이식실험 동안 Cd, Cr, Cu, Pb 및 Zn의 농도가 점차적으로 증가하였으며, AM과 홍합 모두 Zn의 농축이 다른 원소에 비해 높은 것으로 나타났다. AM과 이식된 홍합 내 Cd, Cu 및 Pb는 통계학적으로 유의한 상관성을 보여 유사한 농축 특성을 가지고 있으나, Cr과 Zn는 AM과 홍합간에는 다른 농축 특성을 가지는 것으로 나타났다. 해수 중 용존 상태의 중금속과 AM 및 홍합 내 중금속간의 상관분석결과, Cd, Cu 및 Zn 농도는 홍합보다는 AM과 높은 상관성을 보였다. AM이 자연적인 홍합에 비해 중금속 축적 및 오염원 평가에 대한 확실한 지역적 차이를 보이며 해수 중 용존 중금속 오염을 더 잘 반영하는 것으로 나타났다. 따라서 AM은 해양환경 뿐만 아니라 담수 등에도 이용할 수 있으므로 우리나라 다양한 수환경 내 중금속 오염 연구에 활용도가 높을 것으로 기대된다.
Acknowledgments
본 연구는 한국해양과학기술원 연구사업 “Artificial mussel을 이용한 해양환경 내 중금속 위해성 평가 연구(PE98982)”의 연구비 지원에 의해 수행되었습니다.
References
-
I.Y Ahn, J Ji, H Choi, S.H Pyo, H Park, J.W Choi, “Spatial variations of heavy metal accumulation in Manila clam Ruditapes philippinarum from some selected intertidal flats of Korea”, Ocean Polar Res, (2006), 28(3), p215-224.
[https://doi.org/10.4217/OPR.2006.28.3.215]

-
V Alibabic, N Vahcic, M Bajramovic, “Bioaccumulation of metals in fish of salmonidae family and the impact on fish meat quality”, Environ. Monit. Assess, (2007), 131(1-3), p349-364.
[https://doi.org/10.1007/s10661-006-9480-6]

-
A Becaria, A Campbell, S.C Bondy, “Aluminum as a toxicant”, Toxicol. Ind. Health, (2002), 18(7), p309-320.
[https://doi.org/10.1191/0748233702th157oa]

-
E.A Boyle, S.S Huested, S.P Jones, “On the distribution of copper, nickel and cadmium in the surface waters of the North Atlantic and North Pacific Ocean”, J. Geophy. Res, (1981), 86(C9), p8048-8066.
[https://doi.org/10.1029/JC086iC09p08048]

- J Burger, M Gochfeld, C Jeitner, S Burke, T Stamm, “Metal levels in flathead sole (Hippoglossoides elassodon) and great sculpin (Myoxocephalus polyacanthocephalus) from Adak Island, Alaska: potential risk to predators and fishermen”, Environ. Res, (2007), 103(1), p62-69.
- S.E Calvert, “Mineralogy and geochemistry of nearshore sediments. In: Chemical Oceanography, Vol. 6, 2nd ed. By Riley J.P. and Chester R”, Academic Press, London, (1976), p187-280.
-
S Casas, C Bacher, “Modelling trace metal (Hg and Pb) lation in the Mediterianean mussel, Mytilus galloprovincialis, applied to environmental monitoring”, J. Sea Res, (2006), 56(2), p168-181.
[https://doi.org/10.1016/j.seares.2006.03.006]

- H.G Choi, J.S Park, P.Y Lee, “Study on the heavy metal concentration in mussels and oysters from the Korean coastal waters”, Bull. Kor. Fish Soc, (1992), 25(6), p485-494.
-
N Degger, V Wepener, B.J Richardson, R.S.S Wu, “Application of artificial mussels (AMs) under South African marine conditions: A validation study”, Mar. Pollut. Bull, (2011), 63(5-12), p108-118.
[https://doi.org/10.1016/j.marpolbul.2011.04.040]

-
H Fisher, “Influence of temperature, salinity and oxygen on the cadmium balance of mussels Mytilus edulis”, Mar. Ecol. Prog. Ser, (1986), 32, p265-278.
[https://doi.org/10.3354/meps032265]

-
E.D Goldberg, “The mussel watch - a first step in global marine monitoring”, Mar. Pollut. Bull, (1975), 6(7), p111.
[https://doi.org/10.1016/0025-326X(75)90271-4]

-
E.D Goldberg, V.T Bowen, J.W Farrington, E Robertson, E Schneider, E Gamble, “Mussel watch”, Environ. Conserv, (1978), 5(2), p101-125.
[https://doi.org/10.1017/S0376892900005555]

-
M Gonzalez-Rey, T.C Lau, T Gomes, V.L Maria, M.J Bebianno, S Wu, “Comparison of metal accumulation between ‘Artificial mussel’ and natural mussels (Mytilus galloprovincialis) in marine environments”, Mar. Pollut. Bull, (2011), 63(5-12), p149-153.
[https://doi.org/10.1016/j.marpolbul.2010.12.007]

-
P Grandjean, P Weihe, R.F White, F Debes, S Araki, K Yokowama, K Murata, N Sorensen, R Dahl, P.J Jorgensen, “Cognitive deficit in 7-year-old children with prenatal exposure to methylmercury”, Neurotoxicol. Teratol, (1997), 19(6), p417-428.
[https://doi.org/10.1016/S0892-0362(97)00097-4]

- V.N Iyer, R Sarin, “Chemical speciation and bioavailability of lead and cadmium in an aquatic system polluted by sewage discharge”, Chem. Speciat. Bioavailability, (1992), 4(4), p135-142.
-
G Kibria, T.C Lau, R Wu, “Innovative ‘Artificial mussel’ technology for assessing spatial and temporal distribution of metals in Goulburn-Murray catchments waterways, Victoria, Australia: Effects of climate variability (dry vs. wet years)”, Environ. Int, (2012), 50, p38-46.
[https://doi.org/10.1016/j.envint.2012.09.006]

-
G.F Lauenstein, A Robertson, T.P O’Connor, “Comparison of trace-metal data in mussels and oysters from a mussel watch program of the 1970s with those from A 1980s program”, Mar. Pollut. Bull, (1990), 21(9), p440-447.
[https://doi.org/10.1016/0025-326X(90)90764-Y]

-
G.G Lauenstein, A.Y Cantillo, T.P O’Connor, “The status and trends of trace element and organic contaminants in oysters, Crassostrea virginica, in the waters of the Carolina, USA”, Sci. Total Environ, (2002), 285(1-3), p79-87.
[https://doi.org/10.1016/S0048-9697(01)00897-X]

-
K.M.Y Leung, R.W Furness, J Svavarsson, T.C Lau, R.S.S Wu, “Field validation, in Scotland and Iceland, of the artificial mussel for monitoring trace metals in temperate seas”, Mar. Pollut. Bull, (2008), 57(6-12), p790-800.
[https://doi.org/10.1016/j.marpolbul.2008.01.033]

-
K.M.Y Leung, I.J Morgan, R.S.S Wu, T.C Lau, J Svavarsson, R.W Furness, “Growth rate as a factor confounding the use of the dogwhelk Nucella lapillus as biomonitor of heavy metal contamination”, Mar. Ecol. Prog. Ser, (2001), 221, p145-159.
[https://doi.org/10.3354/meps221145]

-
K.M.Y Leung, J Svavarsson, M Crane, D Morritt, “Influence of static and fluctuating salinity on cadmium uptake and metallothionein expression by the dogwhelk Nucella lapillus (L.)”, J. Exp. Mar. Biol. Ecol, (2002), 274(2), p175-189.
[https://doi.org/10.1016/S0022-0981(02)00209-5]

-
S.N Luoma, P.S Rainbow, “Why is metal bioaccumulation so variable? Biodynamics as a unifying concept”, Environ. Sci. Technol, (2005), 39(7), p1921-1931.
[https://doi.org/10.1021/es048947e]

-
R.O Mason, J.R Reinfelder, F.M.M Morel, “Bioaccumulation of mercury and methylmercury”, Water Air Soil Pollut, (1995), 80(1-4), p915-921.
[https://doi.org/10.1007/BF01189744]

-
T Nawrot, M Plusquin, J Hogervorst, H.A Roels, H Celis, L Thijs, J Vangronsveld, E Van Hecke, J.A Staessen, “Environmental exposure to cadmium and risk of cancer: a prospective population-based study”, Lancet Oncol, (2006), 17(2), p119-126.
[https://doi.org/10.1016/S1470-2045(06)70545-9]

-
T.P O’Connor, “National distribution of chemical concentrations in mussels and oysters in the USA”, Mar. Environ. Res, (2002), 53(2), p117-143.
[https://doi.org/10.1016/S0141-1136(01)00116-7]

-
F Paez-Osuna, M.G Frias-Espericueta, J.I Osuna-Lopez, “Trace metal concentrations in relation to season and gonadal maturation in the oyster Crassostrea iridescens”, Mar. Environ. Res, (1995), 40(1), p19-31.
[https://doi.org/10.1016/0141-1136(94)00004-9]

-
D.J.H Phillips, “Common mussel Mytilus edulis as an indicator of trace-metals in Scandinavian waters. 2. lead, iron and manganese”, Mar. Biol, (1978), 46(2), p147-156.
[https://doi.org/10.1007/BF00391530]

-
D.J.H Phillips, “Biomonitoring of heavy metal availability in the marine environment”, Mar. Pollut. Bull, (1995), 31(4), p183-192.
[https://doi.org/10.1016/0025-326X(95)00116-5]

-
D.J.H Phillips, P.S Rainbow, “Biomonitoring of trace aquatic contaminants”, CRC Press, Boca Raton, FL, (1993).
[https://doi.org/10.1007/978-94-011-2122-4]

-
K Ra, J.H Bang, J.M Lee, K.T Kim, E.S Kim, “The extent and historical trend of metal pollution recorded in core sediments from the artificial Lake Shihwa, Korea”, Mar. Pollut. Bull, (2011a), 62(8), p1814-1821.
[https://doi.org/10.1016/j.marpolbul.2011.05.010]

- K Ra, K.T Kim, J.H Bang, J.M Lee, E.S Kim, S.R Cho, “A preliminary study of environmental impact assessment of tidal power plant in Shihwa Lake, Korea: Heavy metal accumulation in the transplanted Manila clam (Ruditapes philippinarum)”, J. Coastal Rea, (2001b), SI64, p932-936.
-
K Ra, J.G Kim, E.S Kim, K.T Kim, J.M Lee, E.Y Kim, “Vertical profiles and assessment of trace metals in sediment cores from outer sea of Lake Shihwa, Korea”, J. Kor. Soc. Mar. Environ. Energy, (2013), 16(2), p71-81.
[https://doi.org/10.7846/JKOSMEE.2013.16.2.71]

- P.S Rainbow, “Heavy metals in the marine environment. In: Furness, R.W., Rainbow, P.S. (Eds.)”, CRC Press, Boca Raton, FL, (1990), p67-80.
-
P.S Rainbow, “Trace metal bioaccumulation: models, metabolic availability and toxicity”, Environ. Int, (2007), 33(4), p576-582.
[https://doi.org/10.1016/j.envint.2006.05.007]

-
P.S Rainbow, D.J.H Phillips, “Cosmopolitan biomonitors of trace-metals”, Mar. Pollut. Bull, (1993), 26(11), p593-601.
[https://doi.org/10.1016/0025-326X(93)90497-8]

-
B.J Richardson, J.S Garnham, J.G Fabris, “Trace-metal concentrations in mussels (Mytilus edulis planulatus L) transplanted into southern Australian waters”, Mar. Pollut. Bull, (1994), 28(6), p392-396.
[https://doi.org/10.1016/0025-326X(94)90279-8]

-
J.L Sericano, T.L Wade, T.J Jackson, “Trace organic contamination in the Americas: An overview of the US national status and trends and the international mussel watch program”, Mar. Pollut. Bull, (1995), 31(4-12), p214-225.
[https://doi.org/10.1016/0025-326X(95)00197-U]

-
P Statham, “The determination of dissolved manganese and cadmium in seawater at low nmol-1 concentrations by chelating and extraction followed by electrothermal atomic absorption spectrometry”, Anal. Chim. Acta, (1985), 169, p149-159.
[https://doi.org/10.1016/S0003-2670(00)86217-0]

-
M Vinceti, M Venturelli, C Sighinolfi, P Trerotoli, F Bonvicini, A Ferrari, G Bianchi, G Serio, M Bergomi, G Vivoli, “Cast-control study of toenail cadmium and prostate cancer risk in Italy”, Sci. Total Environ, (2007), 373(1), p77-81.
[https://doi.org/10.1016/j.scitotenv.2006.11.005]

-
W.X Wang, N.S Fisher, “Modeling the influence of body size on trace element accumulation in the mussel Mytilus edulis”, Mar. Ecol. Prog. Ser, (1997), 161, p103-115.
[https://doi.org/10.3354/meps161103]

-
W.X Wang, N.S Fisher, S.N Luoma, “Assimilation of trace elements ingested by the mussel Mytilus edulis: effects of algal food abundance”, Mar. Ecol. Prog. Ser, (1995), 129, p165-176.
[https://doi.org/10.3354/meps129165]

-
R.S.S Wu, T.C Lau, “Polymer-ligands: A novel chemical device for monitoring heavy metals in the aquatic environments”, Mar. Pollut. Bull, (1996), 32(5), p391-396.
[https://doi.org/10.1016/0025-326X(95)00154-F]

-
R.S.S Wu, T.C Lau, W.K.M Fung, P.H Ko, K.M.Y Leung, “An ‘artificial mussel’ for monitoring heavy metals in marine environments”, Mar. Pollut. Bull, (2007), 145(1), p104-110.
[https://doi.org/10.1016/j.envpol.2006.03.053]

-
C.K Yap, A Ismail, S.G Tan, H Omar, “Accumulation, depuration and distribution of cadmium and zinc in the green-lipped mussel Perna viridis (Linnaeus) under laboratory conditions”, Hydro-biologia, (2003), 498(1-3), p151-160.
[https://doi.org/10.1023/A:1026221930811]

-
K Zabetoglou, D Vousta, C Samara, “Toxicity and heavy metal contamination of surficial sediments from Bay of Thessaloniki (Northwestern Aegean Sea) Greece”, Chemosphere, (2002), 49(1), p117-126.
[https://doi.org/10.1016/S0045-6535(02)00194-7]