Effect Assessment and Derivation of Ecological Effect Guideline on CO2-Induced Acidification for Marine Organisms
Carbon dioxide capture and storage (CCS) technology is recognizing one of method responding the climate change with reduction of carbon dioxide in atmosphere. In Korea, due to its geological characteristics, subseabed geological CO2 storage is regarded as more practical approach than on-land storage under the goal of its deployment. However, concerns on potential CO2 leakage and relevant acidification issue in the marine environment can be an important subject in recently increasing sub-seabed geological CO2 storage sites. In the present study effect data from literatures were collected in order to conduct an effect assessment of elevated CO2 levels in marine environments using a species sensitivity distribution (SSD) various marine organisms such as microbe, crustacean, echinoderm, mollusc and fish. Results from literatures using domestic species were compared to those from foreign literatures to evaluate the reliability of the effect levels of each biological group and end-point. Ecological effect guidelines through estimating level of pH variation (δpH) to adversely affect 5 and 50% of tested organisms, HC5 and HC50, were determined using SSD of marine organisms exposed to the CO2-induced acidification. Estimated HC5 as δpH of 0.137 can be used as only interim quality guideline possibly with adequate assessment factor. In the future, the current interim guideline as HC5 of δpH in this study will look forward to compensate with supplement of ecotoxicological data reflecting various trophic levels and indigenous species.
초록
이산화탄소 포집 및 저장기술(CCS: Carbon dioxide Capture and Storage)은 이산화탄소(CO2: Carbon dioxide)를 저감하여 기후변화에 대응하는 방법의 하나로 인식되고 있다. 국내에서는 해양지중저장을 통해 CO2의 영구적인 격리를 목표로 연구를 진행하고 있다. 하지만, 이론적으로 안전한 해저 지층구조에 이산화탄소를 저장한다하더라도 CCS 사업과정 또는 중장기적인 지질학적 구조 변형으로 인해 저장된 CO2가 해양환경으로 누출 될 가능성이 존재하기 때문에 CCS사업 추진과정에서 환경 및 생태계 안전에 대하여 많은 관심을 기울여야한다. 만약에 CO2의 누출이 발생할 경우 일차적으로 해수 및 해양퇴적물 내 공극수의 pH를 낮추게 될 것이며, 이로 인해 해양 생물은 부정적인 영향을 받을 수 있다. 따라서 해양생태계를 보호하고 안전한 해양지중저장을 위해서는 이산화탄소에 노출된 해양생물의 영향 정도를 파악하고, 정량적인 생태위해성평가를 통해 합리적인 생태영향기준을 마련하는 것이 CCS 기술의 실용화를 위해서 매우 중요한 요소라 할 수 있다. 이러한 배경하에서 본 연구에서는 누출된 CO2로부터 해양생태계 보호를 위한 생태영향기준 마련을 위해 CO2 노출에 따른 생물영향 자료를 기반으로 종민감도분포(SSD: Species Sensitivity Distribution)를 이용해 해양생물보호를 위한 pH 변화수준(δpH)을 추정하여 정량적 생태위해성평가 기반의 잠정기준을 도출하였다. 정량적 생태위해성평가를 위한 생물영향자료는 미생물, 갑각류, 극피동물, 연체동물, 환형동물, 어류 등 다양한 해양생물에 대한 CO2 노출영향 평가연구자료를 비교·분석하여 확보하였다. 해양생물에 대한 CO2 노출영향 pH 범위는 6.61~8.22 이었으며, 수집된 자료로부터 무영향관찰농도(NOEC: No Observed Effect Concentrations)를 추정하고 종민감도분포를 이용하여 상위 95%의 생물종을 보호할 수 있는 δpH 0.137을 추정하였다. 추정된 δpH는 불확실성을 고려하여 평가계수(assessment factor)를 이용하여 보정하거나, 보정없이 생태영향기준(pH 변화수준)으로 활용될 수 있을 것으로 기대한다. 다만 본 연구에 활용된 생물영향자료가 국내 서식생물 또는 CO2 저장후보지의 지역 특이적인 생물에 대한 자료가 충분하지 않아 명확한 안전수준으로 활용되기에는 제한될 수 있을 것으로 판단된다. 추후 생물영양단계 및 지역특이적으로 서식하는 생물에 대한 충분한 생물영향자료의 보강을 통해 이러한 단점을 보완할 수 있을 것으로 기대한다.
Keywords:
Carbon dioxide capture and storage, Acidification, Leakage, Species sensitivity distribution, Ecological risk assessment, 이산화탄소 포집 및 저장, 산성화, 누출, 종민감도분포, 생태위해성평가1. 서 론
이산화탄소(Carbon dioxide: CO2)는 대기 중에 존재하는 가스이며, 산업발달과 경제적 성장에 의한 화석연료 사용량 증가에 따라 대기 중 농도가 증가하면서 지구온난화 물질로서 기후변화의 원인으로 주목받고 있다(Solomon et al.[2007]). 대기중 CO2 농도 증가는 필연적으로 해수 산성화를 초래하여 해양 생물 및 생태계의 안전성을 위협하기도 한다. 또한 최근 지구 온난화에 대응하기 위한 온실가스 배출 저감기술의 하나로서 전세계적으로 이산화탄소 포집 및 저장기술(CCS)이 현재 주목받고 있다(IPCC[2005]; IEA[2012]). CCS 기술은 발전소 등에서 배출되는 CO2를 포집하여 육상이나 해양의 심부 퇴적층에 처리하는 기술이며, 특히 국내에서는 육상의 공간이 부족하고 아울러 그 지질학적 특성을 고려하여 해양의 퇴적층을 대상으로 한 이산화탄소 지중저장기술이 2020년 이후 실용화를 목표로 연구되고 있다(Kang and Heo[2010~2012]).
그러나 이론적으로 안전한 해저 지층구조에 이산화탄소를 저장한다하더라도 CCS 사업과정(포집-수송-저장단계) 또는 중장기적인 지질학적 구조 변형으로 인해 퇴적층에 저장된 CO2가 해양환경으로 누출 될 가능성이 있다. 따라서 CCS 사업 추진과정에서 환경 및 생태계 안전에 대하여 많은 관심을 기울여야한다. 물론 해저 지질구조에 이산화탄소의 저장을 시도하는 경우, CCS 계획수립 단계에서부터 저장된 CO2의 중장기간 환경 안전성을 확보하기 위하여 모델링 및 모니터링 계획 수립 등 많은 노력을 기울일 것으로 예상한다. 하지만 계획과는 달리 실증화 단계에서 누출에 대한 다양한 가능성이 존재할 수 있다는 것에 대해서도 지적하고 있다(IPCC[2005]). 또한 지중저장을 종료하고 오랜 시간이 지남에 따라 매우 적은 양의 이산화탄소가 지층구조를 따라서 퇴적물 표면으로 스며(seepage) 나올 수 있을 것으로도 예측하고 있다(Van der Zwaan and Smekens[2009]). 이러한 결과는 국지적으로 용존 이산화탄소의 농도가 증가하는 결과를 초래하게 될 수 있을 것이다.
해양에 누출된 CO2는 대기에 비해 확산이 느리고 해수의 화학적 특성을 변화시킬 수 있으므로 장기적으로 해양 생물 및 생태계에 대해 피해를 초래할 가능성이 있다. 예를 들면, 주변 환경이 거의 변하지 않는 심해에 서식하는 생물의 대부분은 누출된 CO2에 의한 pH 변화로 인해 주변 해수의 pH가 0.1 정도만 변해도 유의한 생리적인 영향을 받을 수 있다는 연구 결과가 있으며(Seibel and Walsh [2003]), 상대적으로 pH 변화에 잘 적응하는 연안 생물의 경우에도 pH가 1.0 이상 급격하게 변화하게 되면 피해를 받을 수 있다(Knutzen[1981]). 또한 최근에 해양환경으로 고농도 이산화탄소의 유입은 해수의 화학적 조성을 변화시켜 산호나 석회조류와 같이 탄산염을 이용하여 석회질의 몸체를 구성하는 생물들에게 심각한 피해 영향을 미칠 수 있다는 연구 결과가 나온 바 있으며(Riebesell et al.[2010]), 이산화탄소 자체가 생물에 흡수되어 세포 내 pH 감소와 생화학적 특성 및 기능에 부정적인 영향을 미칠 수 있다고 보고하고 있다(Pörtner[2008]).
이러한 점을 고려하여 국내에서 수행하고 있는 이산화탄소 지중 저장 관련 기술개발 사업에서는 관련 기술개발과 함께 해양 CCS 사업과 관련한 만약의 사고/사건 과정에서 누출될 수 있는 CO2에 의해 해양 환경 및 생태계가 받는 피해를 예측하고 이를 과학적/정책적으로 관리할 수 있는 방안을 모색하기 위한 해양 CCS 환경 위해성평가 관련 연구 사업들을 중점적으로 수행하여 왔다(Kang and Heo[2010/2013]; MLTM[2012]). 외국에서도 해양 CCS 관련 해양환경 관련 연구들도 일부 진행되어 왔다. Gim et al.[2013]은 이러한 CO2 해양지중저장에 대한 환경안전성평가 방안과 개선방안에 대해 언급하고 있다. 일반적으로 CO2에 대한 해양환경위해성평가는 CO2 저장지나 관리지역에서의 누출에 의한 환경영향 및 영향범위를 파악하는 정량적 생태위해성평가 체제를 활용할 수 있다. 이것을 통해 해양 CCS 관련 저장후보지에 대한 허가와 자격부여에 이용될 수 있다(Anonymous[2009]). 하지만 전 세계적으로 해양 CCS가 아직 보편적인 온실가스 감축기술로 실용화되고 있지 않기에 현재까지 해양 CCS 관련 구체적인 CO2 누출의 정량적 위해성평가 방법은 마련되어 있지 않다.
이산화탄소 누출에 의한 생태계 건강성 위협을 파악하기 위해서는 다양한 생태영향 관련 측정 방법들이 동원될 수 있다. 일반적으로 생물에 유해한 영향을 미치는 것으로 인식되는 다양한 독성물질 또는 환경스트레스에 대한 정량적인 생태위해성평가(quantitative ecological risk assessment)를 수행하기 위해서 종민감도분포(SSD: Species Sensitivity Distributions)를 이용(Newman et al.[2000]; Posthuma et al.[2002])하고 있는데, 최근에는 비독성 스트레스(non-toxic stressors) 측정방법을 활용하고 있기도 하다(De Vries et al.[2008]; Smit et al.[2008]; Struijs et al.[2011]). 기본적으로 종민감도분포(SSD) 기법은 독성물질에 대한 생물 종별 민감도에 대한 통계적 분포를 의미하며, 일반적으로 생태계를 대표할 수 있는 몇 몇 대표적인 종에 대한 만성영향에 대한 무영향관찰농도(NOEC: No Observed Effect Concentrations)로 표현된다. 종민감도분포(SSD) 기법은 예측무영향농도(PNEC: Predicted No Effect Concentrations)의 도출에 이용되거나, 특정 노출수준에서 보여질 수 있는 위해의 정도에서 잠재적으로 영향 받을 수 있는 비율(PAF: Potentially Affected Fraction)을 예측하는데 활용된다(De Vries et al.[2008]). 종민감도분포(SSD)를 활용하는 것은 환경에서 대다수의 생물을 보호할 수 있는 독성물질 또는 환경스트레스의 정도를 추정하기 위한 것이다.
본 연구는 국내의 CO2 해양지중저장사업에 따른 CO2 누출로 인한 해양산성화 또는 관련 해양 생태계 영향을 평가할 수 있는 정량적인 위해성평가 수행기반을 마련하기 위한 기초 자료로써 SSD 기법을 통해 CO2에 의한 생태영향기준을 도출하고자 하였다. 따라서, 해양생물의 이산화탄소에 대한 국내 생태영향 자료를 수집하고 증가된 용존 이산화탄소가 해양생물에 미치는 영향 결과를 통해 최종적으로 생태계보호를 위한 생태영향기준(ecological effect guideline)을 제시하고자 하였다. 또한 이산화탄소의 국내 생태영향 자료의 연구결과에 대한 신뢰성을 확인하기 위해 국외의 유사 실험 자료와 비교·분석을 수행함으로서 종민감도분포를 이용하여 추정된 생태영향기준에 대한 해석을 돕고자 하였다.
2. 연구방법 및 재료
CO2에 의한 생물영향기준 도출을 위해 본 연구에서 이용되는 생태영향평가 자료는 본 저자들이 실험을 통해 도출된 결과 및 논문에 보고된 자료를 위주로 원자료를 수집하였다. 수집된 생태영향평가 자료의 대상 실험생물종은 미생물(microbial), 갑각류(Crustacean), 극피동물(Echinoderma), 환형동물(annelid), 어류(fish) 등 5개 분류군을 확인하였으며, 발광미생물(Vibrio fischeri), 두토막눈썹참갯지렁이(Perinereis aibuhitensis), 넙치(Paralichthys olivaceus), 단각류(Monocorophium acherusicum), 요각류(Tisbe sp.), 돌돔(Oplegnathus fasciatus), 말똥성게(Hemicentrotus pulcherrimus), 둥근성게(Strongylocentrotus nudus), 미생물 군집영향 등 최소 9종 이상의 생물이다. 수집된 자료의 노출농도 수준은 해수 저층의 낮은 pH 환경과 주입된 CO2의 저층 퇴적물을 통한 누출을 고려하여 저농도부터 고농도(380~30,100 ppmv)까지 다양한 수준이었다. 노출방법은 제조된 CO2 가스를 해수에 폭기하여 노출하였으며, 다양한 CO2 수준에 폭기된 해수 pH의 범위는 6.61~8.22이었다. 노출시간은 0.33~1,104 시간으로 매우 다양하였으며, 독성종말점(endpoint)은 시험생물에 따라 성장, 수정, 생존, 대사작용 등을 기준으로 하였다(Table 1).
생물영향기준은 일반적으로 종민감도분포(SSD)를 통해서 생물의 5%정도에 위해를 미칠 수 있는 농도 수준을 의미하는 HC5(hazardous concentration for 5% of species), 또는 생물의 95%를 보호할 수 있는 농도 수준을 추정할 수 있다(Van Straalen and Van Rijn[1998]). 종민감도분포(SSD) 추정을 위해 이용하는 생태독성 자료는 만성영향에 대한 무영향관찰농도(NOECs)를 기초로 하며, 추가적으로 평가계수(assessments factor) 10을 적용하여 예측무영향농도(PNEC)를 도출한다(Feibicke and Ahlers[2001]). Ministry of Environment[2013]는 물환경에서 생태위해성평가를 수행 시 종민감도분포(SSD) 분석을 위한 최소자료 요건으로 생물종 4개 분류군에서 최소 5종 이상의 생물종에 대한 자료로 규정하고 있다. 본 연구에서는 수집되는 자료가 이러한 최소자료 요건을 충족할 수 있도록 하였다.
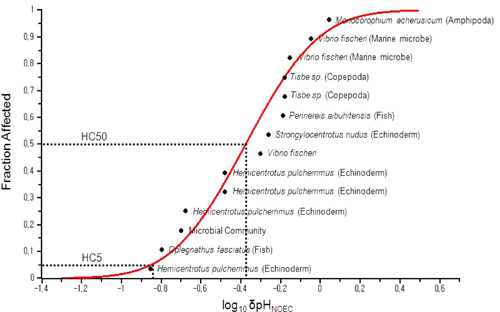
국내연구 결과를 활용하여 CO2 누출에 의한 해양생물을 보호할 수 있는 농도를 추정하기 위해 무영향관찰농도(NOEC)값과 대조군의 차이를 통해 개별 실험결과에 대한 δpH를 계산하였다. 일반적으로 해수의 pH는 해양의 수심 등 조건에 따라 크게 변화하는 특성을 가지고 있으므로 pH 자체와 저해영향의 관계를 SSD로 표현하는것은 상당한 문제가 있다. 따라서 본 연구에서는 각각의 실험 결과에서 대조구와 실험구의 pH 차이인 δpH를 이용하여 SSD를 추정하였다. 종민감도분포(SSD) 추정은 네덜란드 국립환경보건연구소(National Institute for Public Health and the Environment: RIVM)에서 제공하고 있는 ETX 2.0 프로그램을 이용하였다. 이 프로그램은 정량적 생태위해성평가를 위하여 많은 연구에서 활용되고 있다. 추정의 결과는 상위 95%의 생물종을 보호할 수 있는 HC5를 제시하였다.
본 연구가 국내의 해양생물영향기준 도출을 목적으로 하고 있으나, 활용되는 국내 실험결과의 신뢰성을 확인하기 위해 국외연구 결과와 정성적인 비교·평가를 하였다. 국외 자료의 수집을 위해 다양한 검색엔진(Google Scholar, Thomson Reuters, Scopus)을 이용하였고, CO2 산성화에 의한 해양생물 영향에 대한 학술 문헌을 검색하였다. 검색된 관련 논문 중 본 실험과 유사한 내용의 132편을 선별하였으며, 분류된 자료 중 본 연구에서 실험이 이루어진 생물분류군과 종말점이 유사한 자료 30편을 정리하였다(Table 2).
3. 연구 결과
3.1 국내 CO2 노출에 의한 생물영향실험
생물영향 실험결과는 생물종별 최소영향관찰농도(LOEC)의 분포에서 극피동물이 가장 민감한 것으로 나타났으며, 어류, 환형동물, 미생물, 갑각류 순으로 둔감해졌다(Fig. 1A). 특히 극피동물인 성게(sea urchin)의 경우는 CO2에 포화된 해수에 노출되면 수정률이 감소하며, 작은 pH 변화에도 민감하게 반응하는 것으로 나타났다.
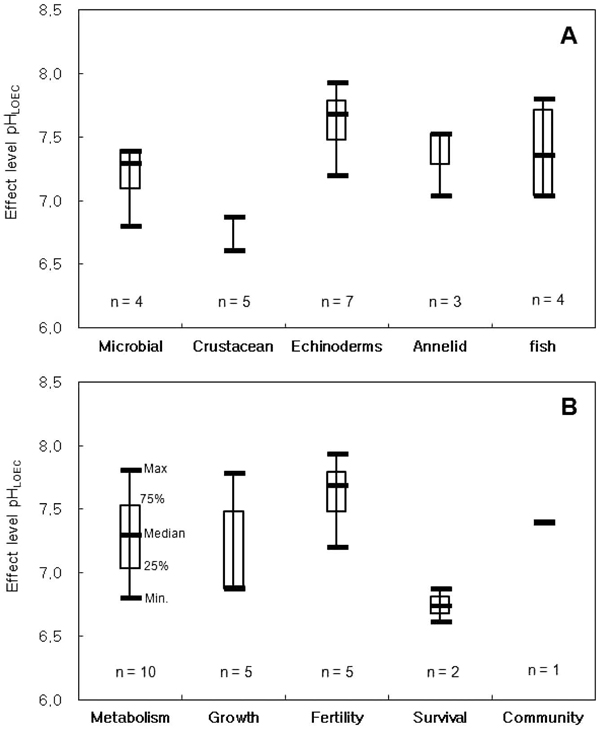
Boxplot of CO2 effect pH levels (LOEC) for species (A) and end-point (B). Boxes indicate first and third quartile, bold line indicates median. Whiskers indicate minimum and maximum (n=number of species).
어류가 다른 생물종보다 민감한 결과가 나온 것은 DNA 손상, CEA와 같은 대사작용 등 세포이하 수준에서 민감하게 반응하는것으로 알려진 독성종말점(end-point)을 채택하였기 때문인 것으로 판단된다. 넙치(Paralichthys olivaceus)에 대한 노출실험에서는 노출시간에 따라 영향이 변화되는 것이 관찰되었다. 이는 넙치의 총 저장된 에너지와 소비된 에너지의 수지를 나타내는 세포에너지할당(CEA: Cellular Energy Allocation) 값을 비교한 것으로 노출 4일 후 농도가 증가하면서 CEA가 약간 감소하는 경향이 있었다. 가장 낮은 CO2 농도인 1000 ppm(pH 7.69)에서도 대조구와 유의한 차이가 나타났다. 반면, 7일째에는 농도가 증가함에 따라 CEA도 증가하는 경향이 있었고, 10일째에는 모든 농도에서 대조구와 차이가 없었다. 결론적으로 CEA는 이산화탄소에 노출되는 비교적 초기에 큰 영향을 받으며 시간이 경과됨에 따라 서서히 안정을 찾아가는 것으로 여겨짐을 알 수 있었다(Moon et al.[2013a]). 해산어류인 돌돔(Oplegnathus fasciatus)의 혈구세포를 이산화탄소에 노출한 후, 이로 인한 유전독성의 일종인 DNA 손상 정도를 확인하였다. 가장 높은 pH(8.22) 조건에서 돌돔 혈구세포의 DNA tail moment는 0.548 ± 0.071 (mean ± S.E) 이었으며, 가장 낮은 pH(7.55) 조건에서 DNA tail moment는 1.601 ± 0.197로 DNA 손상의 정도가 약 2.9배의 차이를 보였다. pH 7.81의 해수에 노출되면 이산화탄소로 산성화된 해수에서 어류 혈구세포의 DNA가 손상되었다(Moon et al.[2013b]).
발광미생물(Vibrio fischeri)은 CO2 노출시간(12, 18, 24 시간)이 증가할수록 발광량 및 세포 밀도의 영향이 감소하는 경향을 보였다. 발광미생물은 pH 7.4 이하의 용존 이산화탄소 농도를 갖는 해수에서 세포 성장에 일시적 저해를 받았고, 이산화탄소 농도와 발광량 및 세포 밀도 간에는 유의한 농도-반응 관계가 관찰되었다. 하지만, 발광미생물의 발광 저해 및 세포 성장은 시간이 지남에 따라 뚜렷하게 회복되는 특성을 보였다. CO2에 장기간 노출된 해양퇴적물의 미생물은 pH 7.4에서 군집의 종 풍부도를 감소시키는 영향을 보였다. 환형동물(annelid)인 두토막눈썹참갯지렁이(Perinereis aibuhitensis)의 지질, 당질, 그리고 단백질 함량과 ETS로부터 에너지 소비율을 계산하여 CEA를 산출한 결과 pH 감소에 따라 CEA가 감소하였다. 낮은 pH 환경에 20일 동안 노출된 요각류(Tisbe sp.)는 성장이 둔화되고, 개체수가 감소하는 것으로 나타났으며, 46일 동안 노출된 단각류(Monocorophium acherusicum)보다 개체수에 영향을 더 받는 것으로 나타났다. CO2에 의한 생물영향은 실험종과 노출시간에 의한 영향차이뿐만 아니라, 실험 종의 독성종말점(end-point)에 따라 민감도의 차이를 보였다. 미생물 군집, 수정률, 대사작용, 성장률 등이 유사한 결과를 보였으며, 생존율에 대한 독성종말점이 가장 둔감한 것으로 나타났다(Fig. 1B).
3.2 해양생태영향기준의 도출
생물영향기준 도출을 위한 종민감도분포(SSD) 추정은 국내에서 실험된 CO2 영향 자료의 NOEC 값과 대조군의 영향 값을 δpH로 계산하여 이용하였다(Fig. 2). 활용된 자료는 미생물, 극피동몰, 환형동물, 갑각류, 어류 5 개 분류군이었으며, 생물종은 Vibrio fischeri를 포함하여 9종이었다. 최종적으로 생태계 보호를 위한 상위 95% 생물종 보호에 대한 δpH의 HC5 값은 0.137, 50% 값인 HC50은 0.423으로 도출되었다. δpCO2에 대한 HC5 값은 231 μatm, HC50값은 1,510 μatm으로 도출되었다. 이러한 값은 이용된 자료의 불확실성을 고려하여 평가계수(assessment factor)를 이용하여 보정한 후 무영향예측농도(PNEC)로 활용될 수 있으며, 잠정적으로 보정 없이 생태계 보호를 위한 기준(guidelines)으로 적용될 수도 있을 것이다.
3.3 국외 문헌 연구와의 비교
국내의 CO2 노출 생물영향결과는 생물종과 노출실험, 독성종말점에 따라 pH에 대한 영향범위의 차이가 보이는 것으로 나타났다. 국내 CO2 생물영향 결과를 정성적인 비교평가를 위해 국외 유사연구결과를 정리하였다(Table 2). 비교 평가는 대사작용, 성장률, 수정률, 생존율, 군집영향 등으로 분류하여 각 생물종 분류에 따라 CO2 영향범위를 비교하였다.
생물 대사작용의 영향은 생물종에 따라 다양한 결과를 보였다. pCO2에 노출되면 pH 8.0에서도 연체동물(Laternula elliptica)은 기초대사량(SMR: Standard Metabolic Rate)이 증가하는 영향을 보였다(Cummings et al.[2011]). 하지만, 일부 연구에서는 조간대상부에 서식하는 연체동물인 총알고둥의 일종인 Littorina의 SMR이 감소하는 것으로 보고하였다(Melatunan et al.[2013]). 물질대사의 감소는 상대적으로 높은 pCO2에 노출된 담치류인 M. galloprovincialis에서도 나타났으며, pH 7.3에 3개월 노출된 M. galloprovincialis는 대사율이 감소하고, 단백질분해가 증가되었으며, 탄산칼슘(CaCO3)으로 구성된 껍질(shell)이 용해되었다는 결과를 보여주었다(Michaelidis et al.[2005]).
해수 중 CO2 농도증가에 따라 생물의 성장과 발달에 관련된 영향은 모든 생물종에서 대체로 민감하게 반응하는 결과를 보였으며, 일부 어류의 경우에서는 성장에 긍정적인 영향을 주는 결과도 확인되었다. spider crab(Hyas araneus)은 pH 7.8에 노출되면 성장률이 감소하고 발달이 느려지는 것으로 나타났다(Walther et al.[2010]). 단각류(Gammarus locusta) 어린개체의 경우는 pH 7.5에서 성장률과 생존에 대한 영향이 뚜렷하지는 않았다(Hauton et al.[2009]). 극피동물의 경우 pH 7.5~7.7에 노출되면 크기 등 발달에 영향을 미치는 것으로 보고되었다(Kurihara et al.[2004b]; Yu et al.[2011]; Stumpp et al.[2011]). 연체동물의 경우 극피동물보다 상대적으로 높은 pH 7.8~8.1조건에서 껍질 또는 larvae의 크기 등 발달에 대한 영향이 나타나는 것으로 알려져 있어 상대적으로 연체동물이 더 민감한 반응을 보이고 있다(Crim et al.[2011]; Gazeau et al.[2010]; Miller et al.[2009]; Lischka et al.[2010]). Munday et al.[2009]는 pCO2에 의한 clown fish(Amphiprion percula)의 배아발달, 알 생존율, 부화크기(hatching size)와 관련된 영향 연구에서는 CO2에 의한 심각한 영향이 나타나지 않았다. 일부 결과에서는 대조군과 비교했을 때 오히려 어류의 성장률이 상승하는 긍정적 결과를 확인하기도 하였다(Munday et al.[2011]). 하지만, 높은 CO2에서 어류 larvae의 성장 시에 후각의 구별능력과 회귀성이 떨어지는 것이 확인되었으나, 후각에 대한 물리적인 영향을 보인 것은 아니었다. 후각신호(olfactory cues)는 대조군(pH 8.15)에서도 회피현상이 나타났으며, pH 7.8에서는 긍정적 반응과 함께 이 현상이 감소하였다. pH 7.6에 노출된 어류 larvae에서는 아무런 영향을 발견할 수 없었다. 후각신호는 잠재적으로 larvae가 정착하는 위치선정에 영향을 줄 수 있는 것으로 알려져 있다. 이후 Munday et al.[2011]연구에서는 pH 8.15와 7.8, 7.6에 노출되었을 때 이석 크기(otolith size), 형태, 대칭에 영향이 없는 것을 확인하였다. 이 결과에서 어류는 산성증(acidosis)을 조절할 수도 있다는 것을 예측하였다.
CO2에 노출된 생물의 수정률에 대한 영향은 성게 등 극피동물의 영향이 상대적으로 민감한 것으로 나타났다. 낮은 pH 조건에서 Heliocidaris erythrogramma는 정자운동성에 영향을 주어 자연적 수정률에 영향을 주었으며(Havenhand et al.[2008]), 성게(Heliocidaris erythrogramma)의 정자운동성이 16.3%, 수정성공률이 24.9%가 감소되어 나타난 결과인 것으로 판단된다(Byrne et al.[2010a]). 극피 동물의 pH 변화에 따른 영향 범위는 7.3~7.8로 수정률과 정자활동성에 영향을 미치는 것으로 나타났다(Reuter et al.[2011]; Moulin et al.[2011]; Ericson et al.[2010]). 이는 국내 성게실험의 영향범위인 pH 7.2~7.9과 유사한 결과를 보이고 있다. 연체동물에 대한 수정률 실험에서는 일부 차이가 있었으며, Havenhand and Schlegel[2009]는 Crassostrea gigas가 pH 7.6에서도 수정률과 정자이동속도에 변화가 없는 결과를 보였으나, Parker et al.[2009]는 온도가 상승할 때 높은 pH(8.0)에서도 시너지 효과가 나타나 수정률이 26% 감소하는 것으로 보고하였다. 하지만, Byrne et al.[2010b]는 연체동물 Haliotis coccoradiata를 온도에 의한 상승효과를 실험하였지만, pH 7.8에서도 영향이 없는 것으로 조사되었다. 이는 종에 따라 생물종 민감도에 따라 다른 결과를 보여주는 것으로 보여진다. CO2에 의한 생물의 생존율에 대한 영향으로 산호 A. tenuis의 주요점막 크기가 감소하는 것을 확인하였으며, pH 7.6에서 생존율이 감소하였다. 하지만 산호 Porites panamensis, 갑각류 Acartia erythraeam와 Semibalanus balanoides는 영향을 확인할 수 없었다(Kurihara et al.[2004a]; Findlay et al.[2010]). 국내연구 결과와 유사한 수준의 pH조건에 노출된 생물의 생존율은 다른 독성종말점에 비해 상대적으로 영향을 덜 미치는 국외연구 결과가 많았다. 군집영향은 Hale et al.[2011]가 pH 7.6에서 종 다양성과 풍부도 감소를 관찰하였으며, 미생물 군집과 관련된 국내연구에서도 노출기간 16일, pH 7.4에서 종풍부도가 감소하는 영향을 보였다.
해수에서 증가된 CO2 농도는 pH를 낮추는 주요한 원인이 되며, 국내연구의 생물영향결과는 극피동물인 성게(Strongylocentrotus nudus)의 수정률이 가장 민감한 영향을 보이는 것으로 나타났다(Fig. 1B). 비교평가를 위한 국외연구에서는 연체동물(굴, 전복, 홍합 등)과 성게 등이 성장률과 수정률이 가장 민감한 것으로 조사되었다. 어류의 대사작용(CEA) 분석결과, 노출시간이 길어질수록 그 영향이 회복되는 긍정적인 효과를 보였다. 또한 국외연구에서는 해수 pH(7.8~8.2)범위에서도 성장률이 상승하는 효과를 보였다. 이 결과를 살펴보면 생물종에 따라, 어류의 경우 CO2에 노출되면 대사작용이 활성화되고, 성장에도 도움을 주는 결과로 해석할 수 있다.
국외연구에서 CO2에 의한 생물영향 SSD 추정 사례는 Pepijn[2013]가 많은 불확실성과 한계점을 이야기하고 있지만, 종민감도분포모델을 활용하여 CO2의 HC5 값을 대조군의 영향(100%)을 기준으로 하여 생물영향값(pH, pCO2)의 변화 크기를 비교하여 기준대비 116%(108~125%, 95% 신뢰구간)로 제시하였다.
4. 토 의
CO2를 해양지중저장하는 경우 다양한 요인에 의해서 누출사고가 발생할 가능성이 있다. 누출된 CO2 로부터 해양생태계를 보호하기 위해서는 정량적 생태위해성평가가 필수적이다. 정량적 위해성평가는 생태영향기준이 필요하며, 이는 CO2에 대한 생태영향평가 자료를 수집하여 종민감도분포(SSD) 추정을 통해 얻어질 수 있다. 본 연구에서는 CO2에 의한 생물영향자료를 국내 실험종을 통한 결과를 수집하였으며, 이를 통해 제한적이지만 SSD를 추정하였다.
SSD에 이용된 자료는 객관성을 확인하기위해 국외 자료와 비교 하였다. pH에 의한 생물영향 차이는 대사작용과 성장률이 수정률, 생존율에 비해 크게 나타났다. 상대적으로 민감도가 국내연구에서는 작았으며, 국외연구에서는 크게 나타났다. 이는 생물종에 따라 대사작용과 성장률이 민감도의 차이를 보이는 것으로 예상된다. 같은 종(Hemicentrotus pulcherrimus)인 성게의 성장발달은 국내외 연구가 유사한 결과를 보였다. 또한, 대사율은 생물종에 따라 국내외 연구에서 증가하거나, 감소하는 공통된 특징을 보였다. 국내연구의 어류 대사작용(CEA) 분석결과는 노출시간이 길어질수록 그 영향이 회복되는 긍정적인 효과를 보였다. 국외연구에서는 일반적인 해수의 pH 범위(7.8~8.2)에서도 성장률이 상승하는 효과를 보였다. 이 결과를 살펴보면 생물종에 따라, 어류의 경우 CO2에 노출되면 대사작용이 활성화되고, 성장에도 도움을 주는 결과로 해석할 수 있으며, 국내외 연구 결과의 연관성을 확인 할 수 있다. 수정률은 극피동물인 성게(Strongylocentrotus nudus)의 수정률이 가장 민감한 영향을 보이는 것으로 나타났다. 국외연구에서는 연체동물(굴, 전복, 홍합 등)과 성게 등의 성장률과 수정률이 가장 민감한 것으로 조사되었다. 생존율은 독성종말점 중에서 국내외 연구 모두 가장 둔감한 것으로 나타났다. 제한적인 자료이지만 국내외연구 결과를 비교해 보면, 국내연구의 pH 변화에 대한 생태영향 연구와 국외 연구는 비슷한 경향을 보였다.
생태위해성평가를 정량적으로 수행하기 위해서는 가장 먼저 신뢰성 있는 생태영향자료를 확보하는 것이 매우 중요하다. 유해물질에 대한 생태영향은 실험조건 또는 독성종말점의 선택과 측정방법에 따라 그 결과가 달라질 수 있으며, 자료 활용에 있어서 많은 제한이 있을 수 있다. 특히, 종민감도분포(SSD)를 이용한 정량적 생태위해성평가는 다양한 생물에 대한 생태영향자료를 활용하기 때문에 분포 추정에 대한 신뢰성과 그 결과의 활용에 제한이 있을 수 있다. 정량적 생태위해성평가를 수행하기 위해서는 요구되는 최소 자료의 건수 또는 근간이 되는 자료의 신뢰성 평가와 관련된 기준이 있으며, 이러한 기준을 바탕으로 수집된 자료의 종민감도분포 추정을 위한 활용여부를 결정하게 된다. ECHA(European Chemicals Agency[2008])는 정량적 생태위해성평가를 위한 생태영향평가 결과의 신뢰성 확인을 위한 다음의 5가지 기준을 제시하고 있다: 먼저 (1) 대표적인 유해물질을 대상으로 생태영향을 평가하였는지, (2) 적절한 생물종을 이용하여 생태영향을 평가하였는지, (3) 적절한 노출경로(exposure route)를 통해 생태영향을 평가하였는지, (4) 시험생물에 대한 노출용량(exposure dose)이 적절하였는지, 마지막으로 (5) 독성종말점(end-point)에 영향을 주는 모든 변수를 고려하였는지 등이다.
본 연구에서 추정된 CO2의 영향에 의한 SSD는 자료의 한계성을 내포하고 있다. 이를 검토하기 위해 수집된 생태영향평가 자료를 대상으로 ECHA가 제시한 5가지 기준을 적용하여 평가하였으며, 그 결과는 다음과 같이 요약될 수 있다.
(1) 수집된 생태영향평가 자료는 CO2에 의한 pH 변화에 따른 영향을 조사하였다. 해수는 CO2 노출에 의해 pCO2(partial CO2 pressure) 변화, 탄산염의 화학적 작용 등 많은 화학적 변화가 일어날 수 있다. pH의 변화가 이것을 모두 대표할 수는 없을 것이다.
(2) 종민감도분포(SSD)를 추정하기 위한 최소 조건인 4개 분류군, 5개 생물종 이상을 선택하였다. 수집된 자료에서 활용된 생물종은 극피동물, 갑각류, 어류, 환형동물, 미생물 등을 포함하고 있다. 이것이 모든 생물종에 대한 민감도를 대표할 수는 없지만, CO2에 의한 해양생태계 영향을 일부는 반영하는 것으로 간주할 수 있을 것이다.
(3) CO2 노출 경로는 대부분의 실험에서 CO2 가스를 이용하여 해수에 폭기하는 방법을 이용했다. 이는 산소가 CO2로 대체되면서 나타나는 저산소증 영향(hypoxic effect)를 반영하지 못하는 결과가 나타날 수도 있다. 또한, CO2의 누출은 모든 생물종에 많은 양이 급격하게 노출될 수 있는 최악의 시나리오로 진행 될 수 있는데, 보통 실험은 낮은 농도부터 단계적으로 CO2에 노출되어 이를 대변하지 못하고 있다.
(4) 독성영향평가에서 일반적으로 적절한 농도에 대한 노출실험을 위해서는 먼저 영향농도범위 파악을 위한 실험을 진행한 후, 최종적인 용량-반응 결과를 얻을 수 있다. 하지만 CO2 누출에 대한 생태영향 연구는 가상 시나리오에 의해 노출농도가 결정되었으며, CO2 영향에 대한 대부분의 문헌 자료 또한 CO2 농도 변화에 대한 예상 시나리오에 의해 결정되었다. 정량적 위해성평가는 여러 노출 용량에 대한 정보가 필요하지만, 그러한 실험결과는 제공하지 못했다.
(5) 독성종말점에 영향을 주는 주요 변수는 대조군의 CO2 농도나 pH, 온도, 염분, 노출기간 등을 고려할 수 있을 것이다. 이러한 변수는 CO2의 생태독성영향 평가에 많은 영향을 줄 수 있다. 대조군의 실험농도는 일반적인 해수의 pCO2와 pH(7.8~8.2)를 범위를 이용하였다. 하지만 이 범위에서도 생물종에 따라 영향이 나타날 수 있으며, SSD 추정에 이용된 ΔδpHNOEC 값이 대조군과 실험군 간에 차이가 없어 그 영향이 나타나지 않는 경우도 발생할 수 있다. 온도는 실험종의 화학적 평형과 생리적 과정에 중요한 영향을 미치는 것으로 판단된다. Parker et al.[2010] 연구와 같이 온도에 따라 CO2 영향이 시너지효과를 나타낼 수도 있고, 전혀 영향이 없을 수도 있다. 하지만, 본 연구의 실험에서는 온도에 대한 자료를 제공하지 못하고 있다. 해양의 염분은 33~35 psu 값을 보여주고 있으며(National Oceanographic Data Center[2009]), 생태위해성평가에서 중요한 변수가 되지는 못하고 있다. 노출기간은 SSD에서 일반적으로 만성적인 독성영향자료를 요구하지만, 본 CO2 연구에서는 만성영향 뿐만 아니라, 급성영향도 고려하기 위해 수분에서 수 개월까지 다양한 영향자료를 제시하고 있다.
수집된 생태영향평가 자료는 생태위해성평가 대상 해양에 서식하는 다양한 생물종에 대해서 실험한 결과가 아니다. 또한 다양한 조건의 CO2 노출농도에 대한 실험을 평가한 자료도 아니다. 따라서 수집된 자료의 한계성과 제한점이 있으며, 종민감도분포(SSD)를 통해 추정된 HC5는 많은 불확실성을 내포하고 있다. 불확실성을 줄이는 종민감도분포(SSD) 추정을 위해서는 이용된 자료의 CO2영향에 대한 대표성, 적절한 생물종, 노출경로, 실험 노출용량, 종말점 등을 고려하여 실험된 영향 자료를 이용해야 한다. CO2의 누출에 의한 생물영향 실험은 이산화탄소 저장후보지의 해양저서환경 특성과 해양생물의 영향을 반영하기 위해 현장조건(고기압, 저온)에서의 CO2 노출 실험을 진행할 필요가 있다. 따라서 화학물질에 대한 독성영향평가와 마찬가지로 CO2에 의한 영향평가방법을 규정하고, 이를 바탕으로 수집된 자료를 반영하여 종민감도분포(SSD)를 추정하고 생태영향기준을 도출할 필요가 있을 것이다.
국내에서는 동해 일부해역을 대상으로 육상에서 포집된 CO2의 잠재적 저장후보지를 찾는 사업이 수행되고 있다. 비록 CO2가 저장되는 곳은 해저면에서 1.5 km 이상 깊이의 지층구조로서 CO2가 누출된 가능성은 매우 낮다 하더라도 장기간에 걸쳐 많은 양의 CO2를 저장하는 과정에서 인위적 혹은 자연적인 원인에 의하여 CO2가 해양으로 누출되는 사고가 발생할 수 있을 것이다. 본 연구에서는 종민감도분포를 활용하여 CO2의 누출로 인해 해수가 산성화되었을 때 해양생물을 보호할 수 있는 영향 기준을 0.137의 δpH로서 도출하였다. 이와 같은 생태영향기준은 향후 다양한 CO2의 누출 시나리오를 기반으로 해양 생물에 나타날 수 있는 피해 해역의 시간적 공간적 범위를 추정하는 데에 활용될 수 있을 것으로 사료된다.
IPCC[2005]는 해수중 CO2 1톤이 존재할 때의 해수부피와 δpH, δpCO2의 관계를 제시하였다. 이것을 바탕으로 생물보호를 위해 제시한 δpH 0.137의 영향범위를 추정해보면, 해수 중으로 1톤의 CO2가 누출되면, 최대 520,243 m3가 영향을 받을 수 있을 것으로 추정되는 값이다(Table 3). 이 정도의 해수 부피는 대략 삼면이 80 m인 입방체 정도의 수괴가 될 수 있을 것으로 예측된다.
하지만, 보다 정확한 예측을 위해서는 앞으로 저장 후보지별로 누출규모에 대한 시공간적 확률분포, 누출 CO2의 확산과 관련된 영향범위를 산출할 수 있는 물리화학적 예측 모델의 개발이 선행되어야 한다. 이를 통하여 다양한 조건에서 나타날 수 있는 해양환경의 생태학적 위해성을 합리적으로 관리할 수 있는 기반이 마련될 수 있을 것이다.
본 연구를 통해 제시하고자 하는 생태계보호를 위한 CO2에 대한 생태영향기준은 실험 노출농도와 실험 건수가 매우 제한적이었으며, 무영향관찰농도(NOEC)값은 다양한 CO2 농도와 pH 범위에서 양적으로 정확한 값을 판단할 수는 없었으며, 생물종에 대해 항상 만성적인 영향을 제시할 수도 없었다. 정량적 생태위해성평가의 종민감도분포(SSD) 추정에서는 매우 중요한 요소이나 본 연구결과는 이를 모두 반영하지 못하였다. 하지만, 본 연구의 국내 생물종에 의한 SSD 추정은 국내 CO2 해양지중저장의 대상 해역에 대한 평가의 기초 자료로 활용 될 수 있을 것으로 판단된다. 추후 CO2저장지의 현장생물을 대상으로 하는 CO2 영향 실험을 통해 종민감도분포 추정하여 보다 신뢰성 있는 결과를 도출 할 수 있을 것이다.
Acknowledgments
이 논문은 2013년 해양수산부의 재원으로 한국해양과학기술진흥원의 지원을 받아 수행된 연구입니다(CO2 해양지중저장기술개발). 또한 2013년 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 지원을 받아 수행한 연구 과제(No.20094010200030)입니다. 이에 감사드립니다.
References
-
H Anlauf, L D'Croz, A O'Dea, “A corrosive concoction: The combined effects of ocean warming and acidification on the early growth of a stony coral are multiplicative", J. Exp. Mar. Biol. Ecol, (2011), 397, p13-20.
[https://doi.org/10.1016/j.jembe.2010.11.009]

- Anonymous, “Directive 2009/31/EC of the European Parliament and of the Council of 23 April 2009 on the geological storage of carbon dioxide and amending Council Directive 85/337/EEC”, European Parliament and Council Directives 2000/60/EC, 2001/80/EC, 2004/35/EC, 2006/12/EC, 2008/1/EC and Regulation (EC) No. 1013/2006. Off. J. Eur. Union L140, (2009), p114-35.
-
M Byrne, N Soars, P Selvakumaraswamy, S.A Dworjanyn, A.R Davis, “Sea urchin fertilization in a warm, acidified and high pCO2 ocean across a range of sperm densities”, Mar. Environ. Res, (2010a), 69, p234-239.
[https://doi.org/10.1016/j.marenvres.2009.10.014]

-
M Byrne, N.A Soars, M.A Ho, E Wong, D McElroy, P Selvakumaraswamy, S.A Dworjanyn, A.R Davis, “Fertilization in a suite of coastal marine invertebrates from SE Australia is robust to near-future ocean warming and acidification”, Mar. Biol, (2010b), 157, p2061-2069.
[https://doi.org/10.1007/s00227-010-1474-9]

-
R.N Crim, J.M Sunday, C.D.G Harley, “Elevated seawater CO2 concentrations impair larval development and reduce larval survival in endangered northern abalone (Haliotiskamtschatkana)”, J. Exp. Mar. Biol. Ecol, (2011), 400, p272-277.
[https://doi.org/10.1016/j.jembe.2011.02.002]

-
V Cummings, J Hewitt, A van Rooyen, K Currie, S Beard, S Thrush, J Norkko, N Barr, P Heath, N.J Halliday, “Ocean acidification at high latitudes: Potential effects on functioning of the antarctic bivalve Laternulaelliptica”, PLoSOne, (2011), 6(e16069).
[https://doi.org/10.1371/journal.pone.0016069]

-
P De Vries, J.E Tamis, A.J Murk, M.G.D Smit, “Development and application of a species sensitivity distribution for temperature-induced mortality in the aquatic environment”, Environ. Toxico. Chem, (2008), 27, p2591-2598.
[https://doi.org/10.1897/08-056.1]

-
J.A Ericson, M.D Lamare, S.A Morley, M.F Barker, “The response of two ecologically important Antarctic invertebrates (Sterechinusneumayeriand Parborlasiacorrugatus) to reduced seawater pH: Effects on fertilisation and embryonic development”, Mar. Biol, (2010), 157, p2689-2702.
[https://doi.org/10.1007/s00227-010-1529-y]

- European Chemicals Agency, “Guidance on Information Requirements and Chemical Safety Assessment Chapter R.10: Characterisation of dose [Concentration]-Response for Environment”, Helsinki, Finland, (2008).
- M Feibicke, J Ahlers, “Environmental effects assessment for substances with large database some more detailed explanations. Prepared for EU-ECB special technical meeting: PNEC derivation for data-rich substances”, Umwelt Bundes Amt, Berlin, (2001).
-
H.S Findlay, M.A Kendall, J.I Spicer, S Widdicombe, “Relative influences of ocean acidification and temperature on intertidal barnacle post-larvae atthenorthern edge of their geographic distribution”, Estuar. Coast. Shelf Sci, (2010), 86, p675-682.
[https://doi.org/10.1016/j.ecss.2009.11.036]

-
F Gazeau, J.-P Gattuso, C Dawber, A.E Pronker, F Peene, J Peene, C.H.R Heip, J.J Middelburg, “Effect of ocean acidification on the early life stages of the blue mussel(Mytilusedulis)”, Biogeosci. Discuss, (2010), 7, p2927-2947.
[https://doi.org/10.5194/bgd-7-2927-2010]

-
B.M Gim, T.S Choi, J.S Lee, Y.G Park, S.G Kang, E.C Jeon, “Evaluation system of environmental safety on marine geological sequestration of captured carbon dioxide”, J. KOSMEE, (2013), 16(1), p42-52.
[https://doi.org/10.7846/JKOSMEE.2013.16.1.42]

-
R Hale, P Calosi, L McNeill, N Mieszkowska, S Widdicombe, “Predicted levels of future ocean acidification and temperature rise could alter community structure and biodiversity in marine benthic communities”, Oikos, (2011), 120, p661-674.
[https://doi.org/10.1111/j.1600-0706.2010.19469.x]

-
C Hauton, T Tyrrell, J Williams, “The subtle effects of sea water acidification on the amphipod Gammarus locusta”, Biogeosci. Discuss, (2009), 6, p919-946.
[https://doi.org/10.5194/bgd-6-919-2009]

-
J.N Havenhand, F.-R Buttler, M.C Thorndyke, J.E Williamson, “Near-future levels of ocean acidification reduce fertilization success in a sea urchin”, Curr. Biol, (2008), 18, p651-652.
[https://doi.org/10.1016/j.cub.2008.06.015]

-
J.N Havenhand, P Schlegel, “Near-future levels of ocean acidification do not affect sperm motility and fertilization kinetics in the oyster Crassostreagigas”, Biogeosciences, (2009), 6, p3009-3015.
[https://doi.org/10.5194/bg-6-3009-2009]

- International Energy Agency(IEA), “Energy Technology Perspectives 2012”, http://www.iea.org/publications/freepublications/publication/ETP_Executive_Sum_Korean_WEB.pdf, (2012).
- IPCC, “IPCC Special Report on Carbon Dioxide Capture and Storage, Intergovernmental Panel on Climate Change 2005”, ISBN-13 978-0-521-86643-9, (2005).
- S.G Kang, C Heo, “Report on development of technology with CO2 marine sequestration”, Ministry of Oceans and Fisheries (MOF), (2010, 2011, 2012, 2013).
-
J Knutzen, “Effects of decreased pH on marine organisms”, Mar. Pollut. Bull, (1981), 12, p25-29.
[https://doi.org/10.1016/0025-326X(81)90136-3]

-
H Kurihara, S Shimode, Y Shirayama, “Effects of raised CO2 concentration on the egg production rate and early development of two marine copepods (Acartiasteueri and Acartiaerythraea)”, Mar. Pollut. Bull, (2004a), 49, p721-727.
[https://doi.org/10.1016/j.marpolbul.2004.05.005]

-
H Kurihara, S Shimode, Y Shirayama, “Sub-lethal effects of elevated concentration of CO2 on planktonic copepods and sea urchins”, J. Oceanogr, (2004b), 60, p743-750.
[https://doi.org/10.1007/s10872-004-5766-x]

-
H Kurihara, Y Shirayama, “Effects of increased atmospheric CO2 on sea urchin early development”, Mar. Ecol. Prog. Ser, (2004), 274, p161-169.
[https://doi.org/10.3354/meps274161]

-
S Lischka, J Büdenbender, T Boxhammer, U Riebesell, “Impact of ocean acidification and elevated temperatures on early juveniles of the polar shelled pteropod Limacinahelicina: Mortality, shell degradation, and shell growth”, Biogeosci. Discuss, (2010), 7, p8177-8214.
[https://doi.org/10.5194/bgd-7-8177-2010]

-
S Melatunan, P Calosi, S.D Rundle, S Widdicombe, A.J Moody, “Effects of ocean acidification and elevated temperature on shell plasticity and its energetic basis in an intertidal gastropod”, MEPS2013, (2013), 472, p155-168.
[https://doi.org/10.3354/meps10046]

-
B Michaelidis, C Ouzounis, A Paleras, H.O Pörtner, “Effects of long-term moderate hypercapnia on acid-base balance and growth rate in marine mussels Mytilusgalloprovincialis”, Mar. Ecol. Prog. Ser, (2005), 293, p109-118.
[https://doi.org/10.3354/meps293109]

-
A.W Miller, A.C Reynolds, C Sobrino, G.F Riedel, “Shellfish face uncertain future in high CO2 world: Influence of acidification on oyster larvae calcification and growth in estuaries”, PLoSOne2009, (2009), 4.
[https://doi.org/10.1371/journal.pone.0005661]

- Ministry of Land, Transport and Maritime Affairs (MLTM), “Press Release by Marine Conservation Division of MLTM on 2012. 4. 4”, (2012).
- Ministry of Environment, “환경유해인자의 위해성 평가를 위한 절차와 방법 등에 관한 지침 14조[시행 2013.4.17]”, [환경부 예규 제480호, 2013.4.17, 일부개정], (2013).
-
S.D Moon, J.H Lee, C.G Sung, T.S Choi, K.T Lee, J.S Lee, S.G Kang, “Cellular Energy Allocation of a Marine Polychaete Species (Perinereisaibuhitensis) Exposed to Dissolving Carbon Dioxide in Seawater”, Journal of the Korean Society for Marine Environment and Energy, (2013a), 16(1), p9-16, February 2013.
[https://doi.org/10.7846/JKOSMEE.2013.16.1.9]

-
S.D Moon, T.S Choi, C.G Sung, J.S Lee, Y.G Park, S.G Kang, “Chronic Effect Exposed to Carbon Dioxide in Benthic Environment with Marine Invertebrates Copepod (Tisbesp.) and Amphipod (Monocorophium acherusicum)”, Journal of Environmental Science International, (2013b), 22(3), p359-369.
[https://doi.org/10.5322/JESI.2013.22.3.359]

-
L Moulin, A.I Catarino, T Claessens, P Dubois, “Effects of seawater acidification on early development of the intertidal sea urchin (Paracentrotuslividus)”, Mar. Pollut. Bull, (2011), 62, p48-54.
[https://doi.org/10.1016/j.marpolbul.2010.09.012]

-
P.L Munday, J.M Donelson, D.L Dixson, G.G.K Endo, “Effects of ocean acidification on the early life history of a tropical marine fish”, Proc. R. Soc, (2009), B2009(276), p3275-3283.
[https://doi.org/10.1098/rspb.2009.0784]

-
P.L Munday, M Gagliano, J.M Donelson, D.L Dixson, S.R Thorrold, “Ocean acidification does not affect the early life history development of a tropical marine fish”, Mar. Ecol. Prog. Ser, (2011), 423, p211-221.
[https://doi.org/10.3354/meps08990]

- National Oceanographic Data Center, “World Ocean Atlas”, (2009).
-
M.C Newman, D.R Ownby, L.C.A Mezin, D.C Powell, T.R.L Christensen, S.B Lerberg, B.A Anderson, “Applying species-sensitivity distributions in ecological risk assessment: assumptions of distribution type and sufficient numbers of species”, Environ. Toxicol. Chem, (2000), 19, p508-511.
[https://doi.org/10.1002/etc.5620190233]

-
L.M Parker, P.M Ross, W.A Connor, “The effect of ocean acidification and temperature on the fertilization and embryonic development of the Sydney rock oyster Saccostreaglomerata (Gould1850)”, Glob. ChangeBiol, (2009), 15, p2123-2136.
[https://doi.org/10.1111/j.1365-2486.2009.01895.x]

-
de Vries Pepijn, “To quantitative ecological risk assessemtn of elevated carbon dioxide levels in the mairne environment”, Mrine Pollution Bulletin, (2013), 73(2013), p516-523.
[https://doi.org/10.1016/j.marpolbul.2013.06.039]

-
H.O Pörtner, “Ecosystem effects of ocean acidification in times of ocean warming: a physiologist’ view”, Marine Ecology Progress Series, (2008), 378, p203-217.
[https://doi.org/10.3354/meps07768]

- L Posthuma, G.W Suter II, T.P Traas, “Species sensitivity distribution in ecotoxicology”, CRC Press. LLC. Boca Raton. Fl., USA, (2002).
-
K.E Reuter, K.E Lotterhos, R.N Crim, C.A Thompson, C.D.G Harley, “Elevated pCO2 increases sperm limitation and risk of polyspermy in the red sea urchin Strongylocentrotusfranciscanus”, Global Change Biol, (2011), 17, p163-171.
[https://doi.org/10.1111/j.1365-2486.2010.02216.x]

- U Riebesell, V.J Fabry, L Hansson, J.P Gattuso, “Guide to best practices for ocean acidification research and data reporting. Publications Office of the European Union”, Luxembourg, (2010), p260.
-
R Rosa, B.A Seibel, “Synergistic effects of climaterelated variables suggest future physiological impairment in a top oceanic predator”, Proc. Natl. Acad. Sci., USA2008, (2008), 105, p20776-20780.
[https://doi.org/10.1073/pnas.0806886105]

-
B.A Seibel, P.J Walsh, “Biological impacts of deep sea carbon dioxide injection inferred from indices of physiological performance”, J. of Experimental Biology, (2003), 206, p641-650.
[https://doi.org/10.1242/jeb.00141]

-
M.G.D Smit, K.I.E Holthaus, H.C Trannum, J.M Neff, G Kjeilen-Eilertsen, R.G Jak, I Singsaas, M.A.J Huijbregts, A.J Hendriks, “Species sensitivity distributions for suspended clays, sediment burial, and grain size change in the marine environment”, Environ. Toxicol. Chem, (2008), 27, p1006-1012.
[https://doi.org/10.1897/07-339.1]

- S Solomon, D Qin, M Manning, Z Chen, M Marquis, K.B Averyt, M Tignor, H.L Miller, “Climate Change 2007: The Physical Science Basis - Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change”, Cambridge University Press, Cambridge, (2007).
-
J Struijs, D De Zwart, L Posthuma, R.S.E.W Leuven, M.A.J Huijbregts, “Field sensitivity distribution of macro invertebrates for phosphorus in inland waters”, Integr. Environ. Assess. Manage, (2011), 7, p280-286.
[https://doi.org/10.1002/ieam.141]

-
M Stumpp, S Dupont, M.C Thorndyke, F Melzner, “CO2 induced seawater acidification impacts sea urchin larval development II: Gene expression patterns in pluteus larvae”, Comp. Biochem. Physiol. AMol. Integr. Physiol, (2011), 160, p320-330.
[https://doi.org/10.1016/j.cbpa.2011.06.023]

- C.G Sung, S.D Moon, H.J Kim, T.S Choi, K.T Lee, J.S Lee, S.G Kang, “Influence of increased carbon dioxide concentration on the bioluminescence and cell density of marine bacteria Vibriofischeri”, The Sea Journal of the Korea Society of Oceanography, (2010), 15(1), p8-15.
- C.G Sung, T.W Kim, Y.G Park, S.G Kang, K Inaba, K Shiba, T.S Choi, S.D Moon, S Litvin, K.T Lee, J.S Lee, “Near future levels of seawater acidification by increasing pCO2 decrease fertilization success of the sea urchin, Strongylocentrotusnudus(in review)”, Journal of Marine Systems, (2013).
-
R Suwa, M Nakamura, M Morita, K Shimada, A Iguchi, K Sakai, A Suzuki, “Effects of acidified seawater on early life stages of scleractinian corals (Genus Acropora)”, Fish. Sci, (2010), 76, p93-99.
[https://doi.org/10.1007/s12562-009-0189-7]

-
B Van der Zwaan, K Smekens, “CO2 capture and storage with leakage in an energy-climate model”, Environ. Model. Assess, (2009), 14, p135-148.
[https://doi.org/10.1007/s10666-007-9125-3]

- N.M Van Straalen, J.P Van Rijn, “Ecotoxicological risk assessment of soil fauna recovery from pesticide pplication”, Review of Environmental Contamination and Toxicology, (1998), 154, p85-141.
-
K Walther, K Anger, H.O Pörtner, “Effects of ocean acidification and warming on the larval development of the spider crab Hyas araneus from different latitudes (54° vs. 79°N)”, Mar. Ecol. Prog. Ser, (2010), 417, p159-170.
[https://doi.org/10.3354/meps08807]

-
P.C Yu, P.G Matson, T.R Martz, G.E Hofmann, “The ocean acidification seascape and its relationship to the performance of calcifying marine invertebrates: Laboratory experiments on the development of urchin larvae framed by environmentallyrelevantp CO2/pH”, J. Exp. Mar. Biol. Ecol, (2011), 400, p288-295.
[https://doi.org/10.1016/j.jembe.2011.02.016]