2021년 봄 남해 수괴 분포와 식물플랑크톤 군집의 공간분포 특성
초록
봄 한국 남해 수괴 및 식물플랑크톤 군집의 공간분포를 파악하기 위해 2021년 4월 15개 정점의 표층과 엽록소 a 최댓층(CML)을 대상으로 현장조사를 실시하였다. 결과, 봄 남해의 수괴는 고염수 특성인 쓰시마난류가 지배하였고, 일부에서 한국 고유연안수가 관찰되었지만, 저염 특성의 중국 대륙연안수는 관찰되지 않았다. 엽록소 a 농도는 0.20-2.53 μgL-1 범위에서 0.86±0.58 μgL-1로 변화하여, 연안수에서 1.0 μgL-1 이상 높았고, 쓰시마난류에서 0.5 μg L-1 이하로 낮았다. 식물플랑크톤 종 조성은 43속 74종으로 규조류가 68.4%, 와편모조류가 28.4%, 그리고 규질편모조류 및 유글레나조류가 각 1.6%를 보였다. 표층 현존량은 1.4-150.8 cells mL-1 범위에서 41.1±57.1 cells mL-1로, 연안부에서 100 cells mL-1 이상 높고, 쓰시마난류에서 5-20 cells mL-1 이하로 낮았다. 그리고 표층의 연안 전선 및 일부 해역에서 유기물 점액질이 높게 관찰되었다. 표층 10% 이상 우점율의 우점종은 Pseudo-nitzschia delicatissima, Leptocylindrus danicus, Chaetoceros socialis 및 Nitzschia sp./small size 등이며, CML은 L. danicus가 우점율 54.6%로 최우점종, Karenia sp. cf. mikimotoi가 우점율 12.9%로 차우점하였다. 상관분석 및 주성분 분석에서 봄 남해 식물플랑크톤 군집은 연안수에서 군집다양성이 높았지만, 쓰시마난류에서 낮은 특성으로 수괴의 영향에 따라 특성을 달리하는 것으로 나타났다.
Abstract
We conducted a survey to analyze the water masses and spatial distributions of phytoplankton at 15 stations on the surface and chlorophyll maximum layers (CML) in the South Sea of Korea from April 26 to 28, 2021. As a result, the water mass was dominated by the Tsushima Warm Current (TWC), which is high salinity, and Korean Coastal Waters (KCW) with relatively low salinity were observed, but not observed Chinese Coastal Waters (CCW) with lower salinity. Chlorophyll a concentration of 0.86±0.58 μg L-1 in the range of 0.20-2.53 μgL-1, which was higher than 1.0 μgL-1 in KCW and lower than 0.5 μg L-1 in the TWC. The species composition of the phytoplankton community was 74 species in 43 genera, with 68.4% of diatoms, 28.4% of dinoflagellates, and 1.6% of silicoflagellates and euglenoids, respectively. The phytoplankton standing crop in the surface was changed to 41.1±57.1 cells mL-1 in the range of 1.4-150.8 cells mL-1, which was higher than 100 cells mL-1 in the coastal waters, and decreased to less than 5-20 cells mL-1 in the TWC. In addition, organic mucilage was observed on the coastal front in surface. The dominant species with dominance more than 10% on the surface, followed by Pseudo-nitzschia delicatissima, Leptocylindrus danicus, Chaetoceros socialis, and Nitzschia sp./small size, but in CML, L. danicus was the first dominant species with dominance of 54.6% and Karenia sp. cf. mikimotoi was second dominant species with dominance of 12.9%. According to the correlation analysis and principal component analysis (PCA), the phytoplankton community showed high community diversity in coastal waters, but showed low characteristics in the TWC. It was interpreted that the characteristics were different according to the influence of the water masses.
Keywords:
Water masses, Phytoplankton community, Korean Coastal Waters(KCW), Tsushima Warm Current(TWC), chlorophyll maximum layer(CML), organic mucilage, diversity키워드:
수괴, 식물플랑크톤 군집, 한국고유연안수, 쓰시마난류, 엽록소 a 최댓층, 유기물 점액질, 다양성1. 서 론
식물플랑크톤은 무기영양염을 흡수하여 태양에너지를 합성할 수 있는 광합성 생물로서, 해양생태계의 생명현상을 유지 시키는 에너지 공급자로 먹이사슬의 근간이 된다(Parsons et al.[1984]). 또한 인간 활동으로 해양에 유입되는 부영양화 물질을 직접 이용할 수 있어, 해양환경의 조절자로서 지구의 기후변화 및 탄소순환에 중심적 역할(Yoder and Kennelly[2003]; Behrenfeld et al.[ 2009])은 물론 수산자원 생물의 생산량을 조절하는 기본 인자로서 중요성이 크다(Ryther, 1969). 그러나 식물플랑크톤 군집은 운동능력이 없거나, 미약하기에 해수 유동에 의한 수동적 분포양식을 하게 되어, 수온, 염분, 영양염류 등 물리·화학적 무생물 인자 및 해양 구조에 따라 성장과 분포 특성을 달리하게 된다(Parsons et al.[1984]). 이런 이유로 해양의 기초생산자인 식물플랑크톤 군집 변동은 해양환경을 이해하고, 해양생물의 군집구조 및 해역의 생산능력을 평가하는데 중요한 인자로서 활용되고 있다(Yoon[2011]; Yoon et al.[2020]).
한국 남해는 구로시오해류 지류인 쓰시마난류의 영향은 물론, 중국 대륙연안수(양자강 희석수)의 영향도 강하다(Kim and Rho[1994]; Lie and Cho[2006]). 특히 수온 상승기의 남해는 겨울 활발한 해수 혼합으로 냉각되어 저층에 존재하는 황해 저층냉수 및 한류의 영향을 받는 동해 저층냉수(Lim[1976]; Zhong et al.[2018]), 그리고 한국 연안수의 영향을 강하게 받는다(Kim et al.[2005]). 이중 중국 대륙연안수는 동중국해로 북상하는 쓰시마난류에 의해 남하 경로가 차단되어, 쓰시마난류와 혼합하면서 남해로 유입된 다음 대한해협과 쓰시마 해협을 통하여 대부분 동해로 유출된다(Fukudome et al.[2010]). 이러한 이유로 한국 남해의 해양환경은 이들 다양한 수괴의 세력 확장으로 특성이 결정되며, 강한 중국 대륙연안수의 영향으로 비교적 높은 기초생산력을 유지하게 되어, 수산업 대상인 자원생물의 생산도 높게 된다(Ryther[1969]).
그러나 한국 남해를 포함하는 동중국해 북부 해역은 자원생물의 남획, 지구온난화, 산업발전에 따른 해양오염, 중국 내륙의 건설된 대형 댐에 의한 하천수 유출 감소 등으로 급격한 해양환경 변화가 발생하고 있다. 이러한 이유로 해파리의 대량 발생과 이동(Uye[2008]; Xiao et al.[2019]), 그리고 장마시 대량으로 유출된 하천수의 영향이 제주도 연안해역까지 확장되는 등(Kim et al.[2015]; Lee et al.[2017]), 해양생태계 및 수산업을 포함한 해양산업에 큰 영향을 주고 있다.
그러기에 이 논문은 동중국해 북부 해역의 효율적인 해역 및 자원생물의 이용과 관리, 그리고 해양환경 보전 등에 필요한 기초자료 축적을 목적으로 지속적인 모니터링을 수행하는 연구의 한 부분으로 2021년 봄 한국 남해의 수괴 분포와 식물플랑크톤 군집에 따른 생태구조 특성을 해석하였기에 보고한다.
2. 재료 및 방법
봄 남해의 수괴 분포와 식물플랑크톤 군집의 공간분포를 파악하기 위해 2021년 4월 26일에서 4월 28일까지 15개 정점의 표층과 엽록소 a 최댓층(Chlorophyll Maximum Layer≒수온약층, 이하 CML로 표기)을 대상으로 조사하였다(Fig. 1). 조사는 전남대학교 실습선 새동백호(2,996톤)를 이용하여, 수괴 분석에 필요한 수온, 염분과 기타 기초해양 환경자료인 용존산소 포화도와 엽록소 a 농도는 선박에 장착된 CTD (SBE 19, Sea-bird Electronic, USA) 및 센서로 표층에서 저층까지 측정하였다. 식물플랑크톤 군집 파악을 위한 시료는 로젯샘플러(SBE 32, Sea-bird Electronic, USA)를 이용하여 표층과 CML에서 해수 1 L를 채수하였다. 채수된 시료는 현장에서 최종농도가 2.0%가 되도록 루골 용액으로 고정하여, 광분해 방지를 위해 차광하였다. 고정한 시료는 실험실 차광조건에서 플라스틱 메스실린더를 이용 48시간 이상 정치하여 상등액을 제거하는 과정을 반복하여 최종농도가 10 mL가 되도록 100배 농축하였다. 검경은 1.0 mm 간격의 가로와 세로선이 들어 있는 계수판(No. 5608-C, Rigosha, Japan)에 농축 시료 0.1 mL를 커버글라스로 덮고, 미분간섭장치(DIC)가 부착된 광학현미경(Eclipse 80i, Nikon, Japan)의 100~400X 배율에서 종의 동정과 계수를 하였다. 종 동정은 식물플랑크톤 도감(Cupp[1943]; Hallegraeff et al.[2010]; Omura et al.[2012]) 및 기타 분류 논문들을 이용하였고, 분류체계는 World Register of Marine Species(WoRMS, www.marinespecies.org)를 기준으로 정리하였다.
식물플랑크톤 종 및 현존량 자료는 Primer program (Plymouth Routines in Multivariate Ecological Research)을 이용하여 정점별 다양도 지수(H') 및 우점도 지수(D)를 아래 계산식으로 계산하였다. 그리고 환경 및 식물플랑크톤 관련 인자는 통계프로그램 IBM SPSS 20.0을 이용하여 피어슨 상관계수 및 주성분 분석을 누적 기여율 70%를 기준으로 계산하였다(Yoon et al.[2020]).
- ① 종 다양성 지수: H' = -ΣPi× ln(Pi) (Shannon and Weaver[1963])
- Pi: i번째 종의 점유율
- ② 우점도 지수: D = (Y1 + Y2)/Y(McNaughton[1968])
- Y: 총 세포수, Y1과 Y2: 첫 번째와 두 번째 우점종의 세포수
3. 결과 및 고찰
3.1 환경인자
2021년 4월 남해해역의 표층 수온은 13.9-19.9oC 범위에서 16.5±2.3oC로(평균±표준편차로 이하 표현 방식이 같음) 외해에서 한반도 남부 내륙의 해안선과 거의 평형하게 연안에서 남쪽으로 진행할수록 높아져, 다도해 해역에서 15.0oC, 제주 동부에서 19.0oC 이상으로 높아졌다. 또한 제주도 북동 해역에서 거문도 남부를 따라 16.0-18.0oC 사이의 큰 수온 경도의 연안 전선이 관찰되었다(Fig. 2A). CML은 13.9-19.2oC의 범위에서 15.6±1.5oC로 표층보다 다소 낮았고, 공간적으로는 표층과 유사하게 연안에서 외해로 갈수록 높아지나, 표층의 연안 전선은 확인되지 않았다(Fig. 2B). 또한 수온의 연직 분포에서 얕은 수심을 보이는 일부 연안 정점은 연직 혼합으로 수온약층이 형성되지 않았으나, 수심의 깊은 연안해역은 약 30 m, 그리고 개방해역은 60-80 m 수심에서 발달한 수온약층이 형성되었다. 그리고 Stn 7에서는 수온약층 밑 부분에 약한 수온 역전현상도 관찰되었다(Fig. 2C).
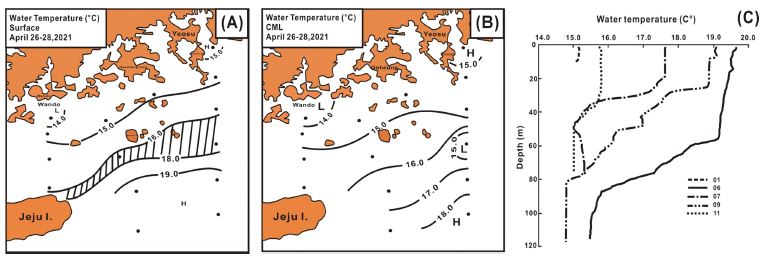
Spatial distributions of water temperature at surface (A) and chlorophyll maximum layer (CML) (B) and its vertical profile at several sampling stations (C).
남해에서 관찰되는 연안 전선은 주로 저온·저염인 연안수와 고온·고염인 쓰시마난류 사이에서 형성되며(Lim[1976]), 계절에 따라 전선의 위치가 크게 변화하는 것이 알려진다(Yang[1994]). 그리고 두 수괴 사이에는 강한 혼합수역이 발달한다(Kondo[1985]). 이러한 연안 전선은 남해의 해양환경 및 생태구조의 변화는 물론 멸치 등 자원생물의 알과 자치어 분포의 제한 인자로 작용하게 되어, 수산 자원생물의 동태에까지 영향을 미친다(Kim et al.[2005]). 그리고 남해에서 관찰되는 수온 역전 현상은 표면냉각과 쓰시마난류의 영향으로 겨울이 여름보다 약 6배 많이 발생하며, 남해 서부는 겨울 다양한 수심에 형성되지만, 여름은 주로 수온약층 아래에, 그리고 동부는 표층에 형성되어 어렵지 않게 관찰되는 것을 보고하였다(Kim and Yug[1983]; Kim[2020]).
염분은 표층에서 32.75-34.64 psu 범위에서 34.16±0.55 psu로 수온과 유사하여, 연안에서 33.5 psu 이하로 낮았지만, 남쪽으로 진행할수록 증가하여, 제주 동부에서 34.5 psu 이상으로 높아졌다. 그리고 제주 북부에서 33.0 psu 이하의 저염수가 남해 중앙부로 유입되었다(Fig. 3A). CML의 염분은 33.34-34.60 psu 범위에서 34.24±0.34 psu로 표층보다 다소 높았고, 공간적으로 연안부에서 34.0 psu 이하로 상대적 낮았으나, 제주 북동 및 동부 먼바다에서 34.5 psu 이상으로 높았다. 그러나 남해 중앙부 대부분 해역의 염분은 34.0-34.5 psu의 균일하였다(Fig. 3B). 그리고 염분의 연직 분포에서 제주 동부 정점은 20 m 수심의 전후에서 염분 역전 형상이 관찰되었고, 60 m 수심에서 약한 염분약층을 형성하였다(Fig. 3C).
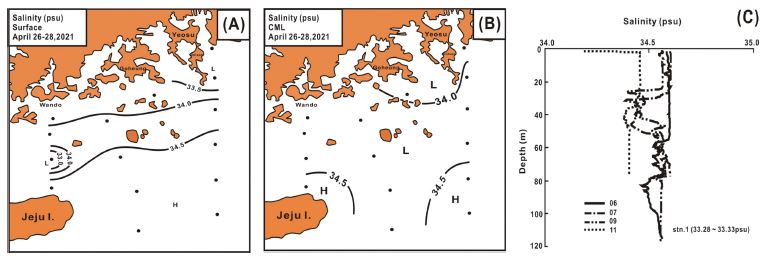
Spatial distributions of salinity at surface (A) and CML (B) and its vertical profile at several sampling stations (C).
봄은 남해에서 연중 가장 높은 염분을 나타내어, 연안에 저염, 외해역에 고염 특징을 보이나(Cho et al.[1995]), 수온과 같은 두 수괴 사이의 급격한 농도 구배는 관찰되지 않았다. 그리고 20 m 수심에서 표층보다 염분이 낮은 해수는 쓰시마난류의 고온·고염의 해수에 서쪽에서 상대적으로 저온·저염이면서 표층수와 유사한 밀도를 가지는 해수가 유입하기 때문이라 할 수 있었다(Cho et al.[1995]).
남해 각 정점의 표층에서 저층까지 1 m 간격으로 측정된 수온과 염분 자료를 이용하여 작성된 T-S diagram를 살펴보면, 다도해 주변의 수심 50 m보다 얕은 해역인 Stn 1, 2, 12-15의 6개 정점군은 저온·저염의 특성을 보였으나, 수심 50 m 이상의 상대적 외해역인 나머지 정점군은 고온·고염의 특성을 보였다. 그러나 외해역에서 수심 50-100 m 범위의 Stn 3, 4, 9-11 등 5개 정점군은 연안해역과 외해역의 혼합된 수괴 특성을 나타내었다(Fig. 4).
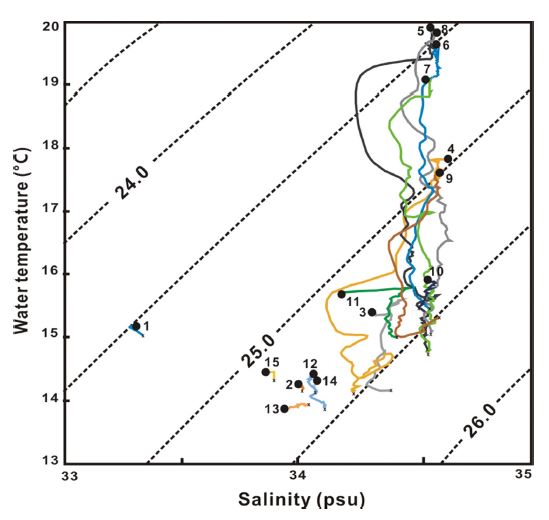
Temperature-salinity diagram in the South Sea in April 2021. (The numbers in the figure represent the sampling stations, and the line represents the change of water temperature and salinity from the surface to the bottom).
봄 남해 연안의 상대적 저온·저염수는 한국 연안고유수(Lim[1976])로, 등심선 100 m 이상 외해의 고온·고염수는 구로시오 확장수인 쓰시마난류로 정의할 수 있으며(Hur et al.[1999]), 이 두 수괴 사이에 혼합특성을 나타내는 혼합수가 관찰되었다(Kondo[1985]), 그러나 봄 남해에서 Gong et al.[1996]에 의해 중국 대륙연안수로 정의하는 31.0 psu 이하의 저염수는 확인되지 않았다(Fig. 4).
용존산소 포화도는 표층에서 83.9-110.2% 범위에서 99.8±6.7%로 여수 금오도 연안, 완도에서 제주를 연결하는 중앙부인 청산도 인근 해역, 그리고 제주도 동남부의 쓰시마난류 해역에서 패치 분포의 형태로 100% 이상의 과포화를 나타내지만, 수심의 낮은 연안해역에서 95% 이하의 불포화를 보였고, 기타 광역적인 개방해역에서 95-100% 포화상태로서 좋은 수질 환경을 나타내었다(Fig. 5A). CML은 93.9-109.3% 범위에서 99.6±4.20%로 표층과 유사하였다(Fig. 5B). 그리고 일부 정점에서 용존산소 포화도의 연직 분포는 표층에서 CML까지 전체적으로 95% 이상의 포화 및 과포화를 보이지만, CML 보다 깊은 수심에서는 약 80%까지 산소포화도가 감소하였다(Fig. 5C).
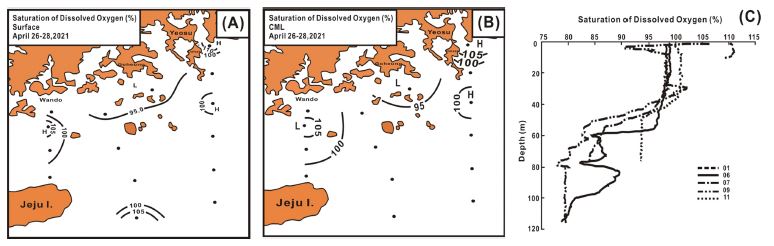
Spatial distributions of saturation of dissolved oxygen at surface (A) and CML (B) and its vertical profile at several sampling stations (C).
용존산소량의 시·공간적 변화는 수온과 염분 함수에 따른 해수의 산소 용해 등 물리적인 인자는 물론 식물플랑크톤과 세균의 광합성 및 분해 활성 등 생물작용에 영향을 받지만(Schurr and Ruchti[1977]), 생물 활동이 없다면 80% 이상의 포화상태를 유지한다(Wang et al.[2003]). 그러나 부영양화가 진행된 내만 및 연안해역 등 인위적 활동이 활발한 해역에서는 고수온기 저서생태계에 영향을 주는 hypoxia (< 2-3 mg L-1)은 물론 해저환경의 산성화를 촉진하여 탄산염 골격을 용해시켜 생태계에 영향을 주는 것이 알려진다(Shin et al.[2013]). 그러나 4월 남해에서는 전체적으로 건강한 수질 환경을 나타내었으며, 소리도 및 청산도 주변의 일부 해역 등 식물플랑크톤 광합성 활성이 활발한 곳에서 패치 분포의 과포화 상태를 나타내었다.
3.2 엽록소 a 농도
엽록소 a 농도는 표층에서 0.20-2.53 μg L-1 범위에서 0.86±0.58 μgL-1로 약 100 m 등심선을 경계로 형성된 연안 전선을 기준으로 연안해역에서 1.0 μgL-1 이상으로 높았고, 외해역에서 0.5 μgL-1 이하로 낮았다. 그리고 청산도 인근의 상대적 저염 해역에서 2.5 μgL-1 이상으로 높았다(Fig. 6A). CML은 1.03-3.90 μgL-1 범위에서 1.87±0.76 μgL-1로 표층보다 평균 2배 이상 높은 농도를 보였고, 공간적으로도 표층과 다르게 완도 청산도 인근 해역 및 쓰시마난류의 Stn 5에서 3.0 μgL-1 이상으로 높은 농도 패치가 관찰되었다. 그리고 청산도 인근의 넓은 해역 및 남해 연도(소리도)에서 제주 북동부를 연결하는 해역이 1.5 μgL-1 이상으로 높았고, 이 두 수역의 중간부에서 1.5 μgL-1 이하로 낮았다(Fig. 6B). 또한 엽록소 a 농도의 연직 분포에서 연안부는 표층에서 높고 수심이 증가와 함께 농도는 감소하였지만, 외해역은 약 30-40 m 수심에서 약 1.5 μgL-1 전후의 농도로 엽록소 a 극대층을 형성하였다(Fig. 6C).
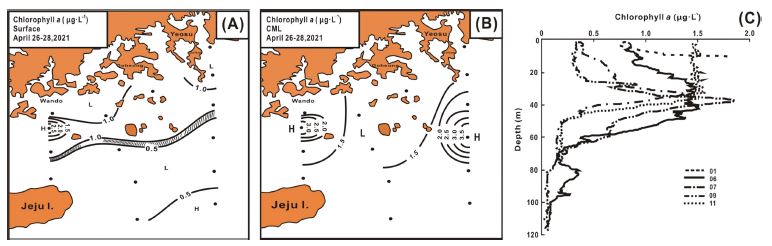
Spatial distributions of chlorophyll a concentration at surface (A) and CML (B) and its vertical profile at several sampling stations (C).
남해 엽록소 a 농도의 분포는 일반적으로 한국 연안고유수 및 중국 대륙연안수, 그리고 쓰시마난류의 확장에 깊게 관련되어(Gong et al.[1996]), 연안수 수괴 및 혼합해역에서 상대적으로 높고, 고온·고염의 빈영양 특성을 나타내는 쓰시마난류에서 낮은 것이 일반적이다(Furuya et al.[2003]; Guo et al.[2014]; Liu et al.[2016]; Yoon et al.[2020]). 이런 이유로 남해의 계절에 따른 엽록소 a 농도는 이들 수괴의 시·공간적 변동 양상에 지배되기에(Ichikawa and Beardsley[2002]), 상대적으로 변동 폭이 큰 특징을 보인다. 그리고 수온약층에서 CML, 즉 엽록소 a 최댓층이 형성되는 것은 표층에서 침강하는 규조류 등이 물리적 경계면에서 집적되거나, 식물플랑크톤 종의 광적응 등에 의한 것으로 알려진다(Gerla et al.[2011]; Yoon[2013]; Baldry et al.[2020]).
3.3 식물플랑크톤 군집
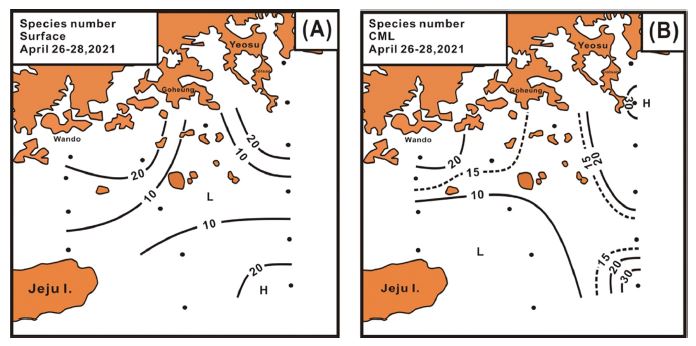
2021년 봄 남해에서 출현이 관찰된 식물플랑크톤은 43속 74종으로 상대적으로 단순하였고, 분류군은 규조류가 29속 51종으로 68.4%의 종 점유율을, 와편모조류가 12속 21종으로 28.4%, 그리고 규질편모조류 및 유글레나조류가 각 1속 1종으로 각 1.6%의 종 점유율을 보였다. 수층별로는 표층이 39속 62종, CML이 41속 65종으로 CML에서 다소 많은 종이 출현하였다. 출현 종수의 공간분포는 표층의 경우, Stn 4의 7종에서 Stn 2의 28종 범위에서 16.5±7.1 종의 변동 폭으로 연안해역 및 쓰시마난류 영향을 강하게 받는 Stn 6에서 20종 이상 출현하였고, 고흥반도 남쪽 해역에서 거문도 인근의 중앙부 해역에서 10종 이하를 보였다(Fig. 7A). CML은 표층에서 Stn 8, 9, 10의 7종에서 Stn 6의 39종 범위에서 17.6±10.6종으로, 표층에서 많은 종수를 보였던 연안해역 및 쓰시마난류의 Stn 6에서 20종 이상이 출현하였고, 표층에서 낮았던 고흥반도 남쪽에서 거문도 인근 해역은 10-15 종 수준, 그리고 제주도 북동의 넓은 해역에서 10종 이하를 나타내었다(Fig. 7B).
남해를 포함하는 동중국해 북부 해역에서 식물플랑크톤 군집을 구성하는 종 조성은 상대적으로 단순하지만(Yoon et al.[2005], [2007], [2020]), 중국 대륙연안수의 확장 등 남해에 영향을 미치는 수괴 분포에 따라 시·공간적 변동 폭이 큰 것이 알려진다(Yoon et al.[2019]). 그러나 남해 및 동중국해에서 식물플랑크톤 군집을 구성하는 분류군은 규조류에 지배되는 것이 일반적이나(Guo et al.[2014]; Yoon et al.[2019]), 계절에 따라서는 와편모조류 등 식물성 편모조류 출현 종수를 지배하기도 한다(Yoon and Koh[1994]; Yoon et al.[2020]). 즉 Yoon et al.[2020]은 여름 제주 남부 해역의 식물플랑크톤 군집을 구성하는 분류군에서 규조류가 32.0%, 와편모조류가 63.0%, 그리고 기타 편모조류가 5.0%로 규조류보다 식물성 편모조류 조성이 2배 정도 높게 나타나는 것을 보고하였다. 그러나 해역의 식물플랑크톤 군집의 종 조성은 연구해역의 범위, 수괴의 다양성, 정점 수, 연구자에 따른 동정 기준 등에 따라 차이를 보이게 된다(Kim et al.[2020]).
식물플랑크톤 현존량은 표층 Stn 4의 1.4 cells mL-1에서 Stn 3의 150.8 cells mL-1 범위에서 41.1±57.1 cells mL-1변동 폭으로 출현 종수가 많았던 연안부에서 100 cells mL-1 이상으로 높았고, 쓰시마난류의 Stn 6은 20 cells mL-1 이상을 보이나, 상대적으로 낮았다. 그리고 출현 종수가 낮았던 고흥반도 남부에서 거문도에 이루는 남서해 중앙부에서 5 cells mL-1 이하로 매우 낮은 현존량을 보였다(Fig. 8A). CML은 Stn 8의 1.7 cells mL-1에서 Stn 1의 730.4 cells mL-1 범위에서 85.9±183.7 cells mL-1로 표층보다 평균 2배 이상 높은 현존량을 나타내었다. 즉 금오도 인근의 Stn 1에서 규조 Leptocylindrus danicus에 의한 극우점으로 500 cells mL-1 이상으로 높았고, 소리도 인근 및 쓰시마난류의 Stn 6 인근에서 100 cells mL-1 이상을 나타내었다. 그러나 낮은 출현 종수를 보인 고흥반도에서 거문도 인근 및 제주 동부에서는 5 cells mL-1 이하를 나타내어, 공간적으로 분포 차가 큰 특징을 나타내었다. 다만 표층에서 높은 현존량을 보였던 완도 연안은 50 cells mL-1 이하로 상대적으로 낮았다(Fig. 8B). 그리고 농축 시료에 많은 양의 침전물이 형성되는 현상이 제주 연안을 포함하여 남해 내만 및 연안에서 어렵지 않게 관찰되었다. 2021년 봄 남해 농축 시료에서도 많은 정점에서 짙은 갈색이 침적물이 관찰되었고, 유류 성분 분석 등을 실시하였지만, 정확한 실체는 파악되지 않았다. Fig. 8C에는 표층에서 이러한 침전물이 관찰된 위치를 표시한 것으로, 연안 전선 및 상대적으로 높은 식물플랑크톤 현존량을 나타내는 해역과 일치하였다.
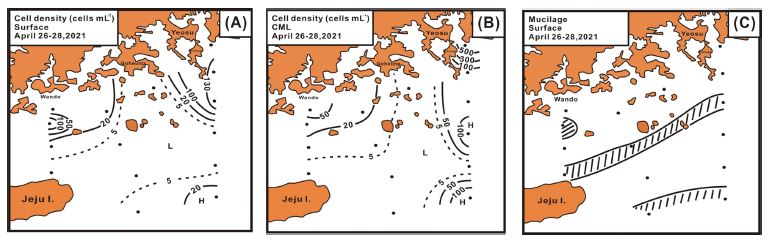
Spatial distributions of phytoplankton standing crop at surface (A), CML (B), and organic mucilage (C).
일반적으로 해역의 식물플랑크톤 현존량은 육지부의 하천수, 심층수의 용승, 그리고 해역의 물질순환 과정의 무기화 등 다양한 영양염류 공급에 의존하게 된다(Parsons et al.[1984]). 남해의 영양염류 공급은 한국 연안고유수 및 중국 대륙연안수에 의해 공급되는 부분이 크며(Kim and Rho[1994]; Kim et al.[2005]; Lie and Cho[2006]; Fukudome et al.[2010]), 한국 남서 해역은 육지부보다 외해에서 공급되는 부분이 큰 것으로도 알려진다(Yoon[2011]). 이러한 이유로 남해의 식물플랑크톤 현존량은 연안수 영향을 받는 해역과 연안 전선 해역에서 높고, 빈영양 특성을 보이는 쓰시마난류에서 낮은 특성을 나타내며(Yoon et al.[2003], [2005]; Guo et al.[2014]; Liu et al.[2016]), 봄 남해의 현존량도 이에 일치하는 분포 양상을 나타내었다. 그리고 표층보다 CML의 높은 식물플랑크톤 현존량을 나타내는 이유는 엽록소 a 농도의 고찰과 같다. 그리고 농축 시료에서 관찰되는 갈색 점액 침전물은 현미경 관찰에서 계수판을 두껍게 도포되어, 종 동정을 방해하기도 하였다(Yoon, unpublished data). 이 침전물은 최근 세계적으로 부영양화가 진행되는 다양한 해역에서 보고되는 유기물 집괴의 일종(Mackenzie et al.[2002]; Danovaro et al.[2009])으로 판단되었고, 봄 남해에서도 연안 전선을 따라 광역적으로 분포하였다. 다만 이러한 유기물 점액질의 형성 원인 및 부영양화 등과의 관련성은 명확하게 할 수 없었다.
식물플랑크톤 군집에서 우점종을 전체 정점 평균 5% 이상 점유하는 종으로 정리하였다(Yoon et al., 2020). 표층은 우상규조 Pseudo-nitzschia delicatissima가 우점율 21.8%로 최우점하였고, 중심규조 L. danicus가 우점율 15.1%로 차우점하였다. 기타 중심규조 Chaetoceros socialis 및 우상규조 Nitzschia sp./small size가 각 우점율 11.5%와 10.5%를 보였고, 중심규조 Chaetoceros curvisetus와 Skeletonema costatum-ls, 그리고 와편모조류 Scrippsiella trochoidea가 우점율 5.0% 전후로 우점하여, 비교적 다양한 종이 우점종으로 출현하였다(Table 1). CML은 표층과는 달리 연안에서 높은 현존량을 보였던 L. danicus가 우점율 54.6%로 극우점하였고, 표층에 우점하지 않았던 와편모조류 Karenia sp. cf. mikimotoi가 우점율 12.9%로 차우점종, 그리고 표층에 우점 출현한 Ch. curvisetus, Nitzschia sp./small size 및 S. costatum-ls 등이 우점율 5.0% 전후로 우점하였다(Table 1).
분류군별 우점율은 표층에서 규조류가 전체적으로 80% 이상을 보이지만, 낮은 현존량을 보였던 제주 동부에서 50~60%의 우점율을 나타내었다(Fig. 9A). CML은 표층의 연안 전선이 형성되었던 해역을 따라 북쪽의 연안부는 규조류가 80% 이상 우점하였지만, 남쪽의 높은 현존량을 제외한 남동부를 제외한 고수온 해역은 와편모조류를 중심으로 하는 식물성 편모조류에 의한 우점율이 60% 이상을 나타내어, 해역에 따른 분류군별 우점 현상에 분명한 차이를 나타내었다(Fig. 9B).
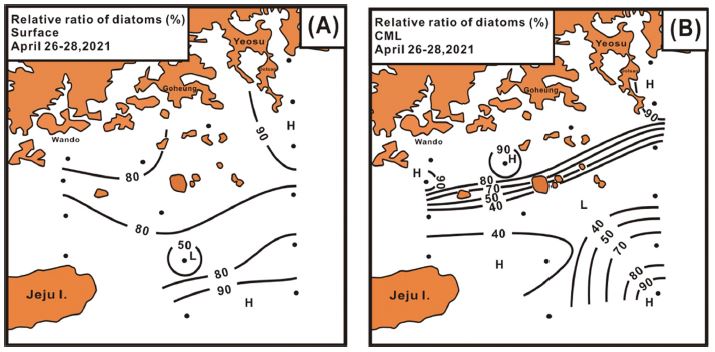
Spatial distributions of the relative ratio of diatoms on the phytoplankton community at surface (A) and CML (B).
최근 50년 남해와 연결된 동중국해의 식물플랑크톤 군집 관련 장기자료 분석에서 우점종 변화는 전반적으로 대형 종에서 소형 종으로, 그리고 온대-아열대의 광온성 종에서 아열대-열대의 광온성종은 변화하며, 연안의 대표적 광염성 종 Skeletonema costatum-ls 출현이 감소하는 것을 보고하였다(Jiang et al.[2014]). 또 중국 대륙연안수 확장되는 대륙붕 해역의 우점종은 해역에 따라 규조류, 와편모조류, 남조류 등 매우 다양하지만, 봄에 20% 이상 우점율을 보이는 종은 Prorocentrum dentatum, S. trochoidea, Nitzschia sp. Paralia sulcata, Pn. delicatissima, Thalassiosira sp. Synedra nitzschioides f. nitzschioides (=Thalassionema nitzschioides), Donkinia recta, Diploneis bombus 등(Guo et al.[2014])으로 보고 된다. 즉 봄 남해에 우점 출현하는 종에 특이점은 없지만, 표층에서 최우점한 Pn. delicatissima는 신경성 패류독(ASP)을 생산하고, 범지구적으로 연안에서 외양까지 광범위하게 분포하면서 봄에서 가을까지 온대 해역에서 대발생이 어렵지 않게 관찰된다(Orsini et al.[2004]). CML에 극우점한 L. danicus는 범지구적으로 봄과 여름에 우점하고(Karthik et al.[2017]), 환경 적응 능력이 탁월하여, 최근 지구온난화의 지표종으로도 취급되며(Ajani et al.[2021]), 한국 연안에 보편적으로 우점한다(Yoon[2011]). 표층에서 10% 이상 우점율을 보인 Ch. socialis는 한류성 종이지만(Sieracki et al.[1998]), 범지구적으로 연안(Cupp[1943]) 및 외양의 부유성 및 저서성(Booth et al.[2002])으로 출현하며, 고위도 해역에서 봄 규조류 대발생의 중요 구성인자(Booth et al.[2002]; Degerlund and Eilertsen[2010])이다. 한국 연안 및 내만에서 저수온기인 겨울과 이른 봄에 주로 우점한다(Yoon[2011]). CML에서 10% 이상 우점율을 보인 Karenia cf. mikimotoi는 대표적 유해적 조생물로 한국 연안에서 1980년대 초 적조 발생으로 막대한 피해를 발생시킨 종이나(Yoon[2010]), 외양역에서 우점 출현은 다소 이례적이지만, 적조군까지 발전 가능성에 대해서는 불확실하였다. 그리고 L. danicus가 표층보다 CML에서 높은 우점율을 보이는 것은 조사 이전 표층에 우점하였던 개체군이 쇠퇴 성장기에 접어들어 침강하면서 CML에 집적되었을 것으로 추정되었다.
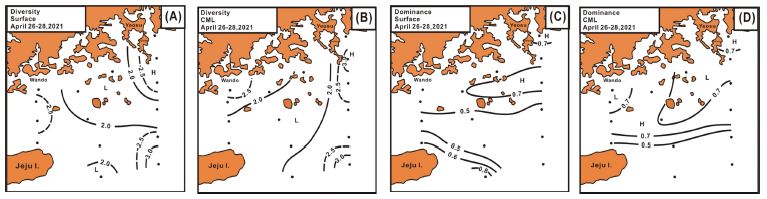
식물플랑크톤 군집구조 파악에 이용되는 생태지수 중, 다양도 지수는 표층에서 1.76-2.97의 범위에서 2.36±0.40으로 변화하여 제주 동부의 쓰시마난류 및 소리도와 청산도 연안에서 2.5 이상으로 높고, 낮은 출현 종수 및 현존량을 나타낸 거문도에서 남해 중앙부에서 2.0 이하로 낮았다(Fig. 10A). CML은 1.39-3.31의 범위에서 2.29±0.52로 표층보다 다소 낮았지만, 표층과 유사한 분포로 제주 동부의 쓰시마난류 및 소리도와 완도 연안에서 2.5 이상으로 높았지만, 제주 북동에서 고흥반도에 이루는 중앙부에서 2.0 이하로 낮았다(Fig. 10B). 우점도 지수는 표층에서 0.28-0.83의 범위에서 0.57±0.17로 연안부 및 제주 동남부에서 0.7 이상으로 높았고, 거문도 남동의 쓰시마난류에서 0.5 이하로 낮았다(Fig. 10C). CML은 0.29-0.96의 범위에서 0.62±0.19로 다양도 지수와는 다르게 표층보다 다소 높았으며, 공간분포는 표층의 높은 지수를 보였던 해역에서 0.5 이하로 낮았고, 제주 북동부의 남해 중앙부에서 0.7 이상으로 높았다(Fig. 10D).
생태지수는 군집 전체에 대한 정확한 동정 등을 기본으로 하는 내용이기에 도출된 지수를 기존의 문헌과 직접적으로 비교하는 것은 어렵다(Guo et al.[2014]). 그러나 봄 남해의 식물플랑크톤 군집의 다양도 지수는 8월 제주 남부의 동중국해 북부보다는 낮았지만(Yoon et al.[2020]), 연안 하구역인 서해 금강 하구 및 연안보다는 높았다(Guo et al.[2014]). 그러나 우점도 지수는 다양도 지수와 반대의 특성을 나타내었다(Guo et al.[2014]; Yoon et al.[2020]). 봄 남해의 식물플랑크톤 군집은 상대적으로 낮은 종 구성에, 해역에 따라서는 특정 종에 의해 지배되는 특성을 보인다고 할 수 있었다.
3.4 식물플랑크톤 출현 및 분포 특성
봄 남해 식물플랑크톤 관련 및 환경 인자 사이의 상관행렬에서 표층의 엽록소 a 농도는 수온과 유의적인 음의 상관을 보이지만, 식물성 편모조류, 우점종 Ch. curvisetus, S. trochoidea에 강한 양의 상관을 나타내고 있어, 상대적으로 낮은 수온을 나타내는 연안부 및 식물성 편모조류에 의해 지배되는 부분이 큰 것으로 나타났다. 기타 생물인자에서 환경인자와 유의적 상관을 보이는 내용은 없지만, 대부분 생물인자는 수온과 염분에 음의 상관을, 그리고 용존산소 포화도와는 양의 상관을 나타내어, 엽록소 a 농도와 같이 고온을 나타내는 쓰시마난류보다는 연안수 영향을 받는 해역을 선호하는 것으로 평가되었다(Table 2, lower). CML은 전체 식물플랑크톤 현존량 및 최우점종 L. danicus가 염분과 유의적 음의 상관을, DOs와 양의 상관을 보였고, 엽록소 a 농도는 식물성 편모조류와 와편모조류 우점종 Karenia sp. cf. mikimotoi에 유의적 양의 상관을 보이는 것에서 상대적 저염수에서 높은 규조류 현존량을 보이지만, 엽록소 a 농도는 규조류의 현존량보다, 단위세포에 대한 엽록소 a 농도가 높은 편모조류(Honjo et al.[1978])에 의해 지배되는 부분이 큰 것으로 평가되었다(Table 2, upper).

Correlation matrix between environmental factors and phytoplankton parameters at surface (lower) and CML (upper)
주성분 분석은 제3 주성분까지 누적 기여율이 표층과 CML 모두에서 71% 수준으로 계산되었으며(Table 3), 표층 인자 부하량 분포에서 제1 주성분은 엽록소 a, 식물성 편모조류와 와편모조류 S. trochoidea (St), 그리고 우상규조 Nitzschia sp./small size (Nsp)에 강한 양의 관계를 보이며, 약하지만 용존산소 포화도와 양의 관계를, 수온과 염분에 약한 음의 관계를 보이는 것에서 상대적 저온, 저염 조건에서 식물성 편모조류의 출현 특성을 나타내는 지표로 해석되었다. 제2 주성분은 출현 종수, 전체 식물플랑크톤과 규조류, 우점 규조류 Ch. socialis (Cs)에 강한 양의 관계를 보였고, 수온과 염분에 약한 음의 관계를 보이는 것에서 상대적 낮은 수온 및 염분, 즉 연안수 특성에서 규조류의 출현 특성을 나타내는 지표로 해석되었다(Fig. 11A). CML 인자 부하량 분포는 제1 주성분에 전체 식물플랑크톤, 우점종 L. danicus (Ld), 용존산소 포화도, 규조류 등이 강한 양의 관계를 보이며, 염분에 강한 음의 관계를 보이는 것에서 상대적 저염수에서 규조류 출현 특성을 나타내는 지표로 해석되었다. 제2 주성분은 엽록소 a, 식물성 편모조류와 와편모조류 K. cf. mikimotoi (Km)에 강한 양의 관계를 보이며, 약하지만 수온, 규조류 S. costatum-ls (Sc)에 음의 관계를 보이는 것에서 상대적 낮은 수온에서의 와편모조류 출현 특성을 나타내는 지표로 해석되었다(Fig. 11B).

Eigen value, proportion and accumulative proportions by principal component analysis (PCA) in surface (left) and CML (right)
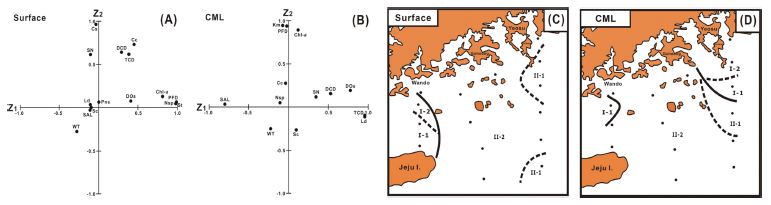
Distribution of the loading factors (A, B) and divisions of the sea area with scores (C, D) by principal component analysis (PCA) at the surface (A, C) and CML (B, D). (See Table 2 for the abbreviations in figures).
즉 표층과 CML의 제1 주성분 및 제2 주성분은 상반된 내용을 함축하고 있었으며, 주성분 분석의 득점을 기준으로 해역을 구분하면, 표층은 제1 및 제2 주성분의 누적 기여율 58.8%를 기준으로 편모조류와 규조류 모두 많은 현존량을 보이면서 저온, 저염의 특성을 나타내는 I-1의 제주 북동부와 편모조류 현존량은 많지만, 규조류 현존량이 적고, 고온 특성을 보이는 I-2의 여서도 서부, 그리고 편모조류 현존량은 적지만, 규조류 현존량이 많고, 저온, 저염을 보이는 II-1의 소리도 인근 및 쓰시마난류의 남쪽 정점과 편모조류와 규조류 현존량이 적고, 고온, 고염 특성을 보이는 II-2의 남해 대부분 해역으로 구분되었다(Fig. 11C). CML은 제1 및 제2 주성분의 누적 기여율 55.7%를 기준으로 규조류와 편모조류 모두 높은 현존량을 보이면서 저온, 저염의 특성을 나타내는 I-1의 남해 소리도 남부와 여서도 서부 해역과 규조류 현존량은 많지만, 편모조류 현존량이 적으면서 상대적 고온 특성을 보이는 I-2의 섬진강 하구의 여수 연안, 그리고 규조류 현존량은 적지만, 편모조류 현존량이 상대적으로 많으면서 저온, 고염 특성을 보이는 II-1의 제주 동부의 먼 쓰시마난류 정점과 규조류와 편모조류 현존량이 적고, 고온, 고염의 쓰시마난류 특성을 보이는 II-2의 남해 대부분 해역으로 구분되었다(Fig. 11D).
4. 결 론
봄 남해의 수괴와 식물플랑크톤 군집, 그리고 상관분석 및 주성분 분석 등의 통계 해석을 통해, 표층 및 CML 모두에서 식물플랑크톤 군집은 상대적으로 낮은 수온 및 염분을 나타내는 연안수에서 높았고, 고온, 고염 특성을 보이는 남해 대부분 해역에서 낮은 특성을 나타내었다. 즉 봄 남해는 한국 연안고유수와 쓰시마난류에 영향을 받고 있으며, 특히 고온, 고염 특성을 보이는 쓰시마난류 세력이 넓게 확장되어(Kim and Rho[1994]; Ichikawa and Beardsley[2002]; Fukudome et al.[2010]), 식물플랑크톤 군집은 상대적 단순한 종 조성에 낮은 현존량을 나타내는 것으로 판단되었다(Yoon et al.[2020]). 즉 남해는 다양한 수괴의 세력 확장에 따라 식물플랑크톤 군집을 시작으로 하는 생태구조에 큰 시·공간적 변동이 발생할 것으로 추정되었다. 따라서 남해의 해양환경 변화 및 수산 자원 생물의 효율적 이용과 관리 등을 위해서는 시계열적인 해양환경 및 생태구조 변화에 따른 장기적 모니터링이 요구된다.
Acknowledgments
이 논문은 2021년 해양수산부 재원으로 해양수산과학진흥원의 지원을 받아 수행된 과제임(ICT기반 수산자원관리 연구센터).
References
-
Ajani, P.A., Petrou, K., Larsson, M.E., Nielsen, D.A., Burke, J. and Murray, S.A. 2021, Phenotypic trait variability as an indication of adaptive capacity in a cosmopolitan marine diatom, Environ. Microbiol. 23(1), 207-223.
[https://doi.org/10.1111/1462-2920.15294]

-
Baldry, K., Strutton, P.G., Hill, N.A. and Boyd, P.W., 2020. Subsurface chlorophyll-a maxima in the Southern Ocean, Front. Mar. Sci., 7, 671.
[https://doi.org/10.3389/fmars.2020.00671]

-
Behrenfeld, M.J., Siegel, D.A., O’Malley, R.T. and Maritorena, S. 2009, Global ocean phytoplankton, in: Peterson, T.C. and Baringer, M.O. (Eds.). State of the Climate in 2008, Bull. American Meteorol. Soc. 90(8), S68-S73.
[https://doi.org/10.1175/BAMS-90-8-StateoftheClimate]

-
Booth, B.C., Larouche, P., Bélanger, S., Klein, B., Amiel, D. and Mei, Z.P. 2002, Dynamics of Chaetoceros socialis blooms in the North Water, Deep-Sea Res. II, 49(22-23), 5003-5025.
[https://doi.org/10.1016/S0967-0645(02)00175-3]

- Cho, Y.K., Kim, K. and Rho. H.K. 1995, Salinity decrease and the transport in the South Sea of Korea in summer, J. Korean Soc. Coast. Ocean Eng. 17(1), 126-134.
- Cupp, E.E. 1943, Marine plankton diatoms of the west coast of north America, Bull. Scripps Inst. Oceanogr. Univ. of California, 5, 1-237.
-
Danovaro, R., Umani, S.F. and Pusceddu, A. 2009, Climate change and the potential spreading of marine mucilage and microbial pathogens in the Mediterranean Sea, PLOS ONE, 4(9).
[https://doi.org/10.1371/journal.pone.0007006]

-
Degerlund, M. and Eilertsen, H.C. 2010, Main species characteristics of phytoplankton spring blooms in NE Atlantic and Arctic waters (68-80°N). Est. Coasts, 33(2), 242-269.
[https://doi.org/10.1007/s12237-009-9167-7]

-
Fukudome, K.I., Yoon, J.H., Ostrovskii, A., Takikawa, T. and Han, I.S. 2010, Seasonal volume transport variation in the Tsushima Warm Current through the Tsushima Straits from 10 years of ADCP observations, J. Oceanogr. 66(4), 539-551.
[https://doi.org/10.1007/s10872-010-0045-5]

-
Furuya, K., Hayashia, M., Yabushita, Y. and Ishikawa, A. 2003, Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures. Deep-Sea Res. Part II-Top. Stud. Oceanogr. 50(2), 367-387.
[https://doi.org/10.1016/S0967-0645(02)00460-5]

-
Gerla, D.J., Mooij, W.M. and Huisman, J. 2011, Photoinhibition and the assembly of light-limited phytoplankton communities, Oikos, 120(3), 359-368.
[https://doi.org/10.1111/j.1600-0706.2010.18573.x]

-
Gong, G.C., Lee, Y.L., Chen, L. and Liu, K.K. 1996, Chemical hydrography and chlorophyll a distribution in the East China Sea in summer: implications in nutrient dynamics. Cont. Shelf Res. 16(12), 1561-1590.
[https://doi.org/10.1016/0278-4343(96)00005-2]

-
Guo, S., Feng, Y., Wang, L., Dai, L., Liu, Z., Bai, Y. and Sun, J. 2014, Seasonal variation in the phytoplankton community of a continental-shelf sea: the East China Sea. Mar. Ecol. Prog. Ser. 516, 103-126.
[https://doi.org/10.3354/meps10952]

- Hallegraeff, G.M., Bolch, C.J.S., Hill, D.R.A., Jameson, I., LeRoi, J.M., McMinn, A., Murray, S., de Salas, M.F. and Saunders, K. 2010, Algae of Australia: Phytoplankton of Temperate Coastal Waters. CSIRO Publ., Cambella.
- Honjo, T., Shimouse, T. and Hanaoka, T. 1978, A red tide occurred at the Hakozaki fishing port, Hakata Bay, in 1973. - The growth process and the chlorophyll content-, Bull. Plankton Soc. Japan, 25(1), 7-21.
-
Hur, H.B., Jacobs, G.A. and Teague, W.J. 1999, Monthly variations of water masses in the Yellow and East China Seas. J. Oceanogr. 55(2), 171-184.
[https://doi.org/10.1023/A:1007885828278]

-
Ichikawa, H. and Beardsley, R.C. 2002, The current system in the Yellow and East China Seas. J. Oceanogr. 58(1), 77-92.
[https://doi.org/10.1023/A:1015876701363]

-
Jiang, Z, Liu, J., Chen, J., Chen, Q., Yan, X., Xuan, J. and Zeng, J. 2014, Responses of summer phytoplankton community to drastic environmental changes in the Changjiang (Yangtzu River) estuary during the past 50 years. Water Res. 54, 1-14.
[https://doi.org/10.1016/j.watres.2014.01.032]

- Karthik, R., Padmavati, G., Sai Elangovan, S. and Sachithanandam, V. 2017, Monitoring the diatom bloom of Leptocylindrus danicus (Cleve 1889, Bacillariophyceae) in the coastal waters of South Andaman Island, Indian J. Geo Mar. Sci. 46(5), 958-965.
- Kim, H.J. and Yug, S.S. 1983, Inversion phenomena of temperature in the southern sea of Korea, Bull. Korean Fish. Soc. 16(2), 111-116.
-
Kim, H.S., Kim, H., Yang, D. and Yoon, Y.H. 2020, Spatio-temporal distribution patterns of phytoplankton community and the characteristics of biological oceanograpic environments in the Geumgang Estuary, West Sea of Korea in 2018. Korean J. Environ. Biol. 38(2), 254-270.
[https://doi.org/10.11626/KJEB.2020.38.2.254]

- Kim, I.O. and Rho, H.G. 1994, A study on China coastal water appeared in the neighbouring seas of Cheju Island, Bull. Korean Fish. Soc. 27(5), 515-528.
-
Kim, J., Kim, H., Paeng, D.G., Bok, T.H. and Lee, J. 2015, Low-salinity induced surface sound channel in the western sea of Jeju Island during summer, J. Acoust. Soc. Ammerica, 137(3), 1576-1585.
[https://doi.org/10.1121/1.4913812]

- Kim, J.I., Kim, J.Y. Choi, Y.K. Oh, H.J. and Chu, E.K. 2005, Distribution of the anchovy eggs associated with coastal frontal structure in southern coastal waters of Korea, Korean J. Ichthyol. 17(3), 205-216.
- Kim, S.H. 2020, Characteristics of water temperature inversion observed in a region west of Jeju Island in April 2015. Ocean Polar Res. 42(2), 97-113.
- Kondo, M. 1985, Oceanographic investigations of fishing grounds in the East China sea and Yellow Sea. I. Characteristics of the mean temperature and salinity distributions measured at 50 m and near bottom, Bull. Seikai Reg. Fish. Res. Lab. 62, 19-66.
-
Lee, J.H., Moon, I.J., Moon, J.H., Kim, S.H., Jeong, Y.Y. and Koo, J.H. 2017, Impact of typhoons on the Changjiang plume extension in the Yellow and East China Seas. J. Geophys. Res.: Oceans, 122(6), 4962-4973.
[https://doi.org/10.1002/2017JC012754]

-
Lie, H.J. and Cho, C.H. 2006, Seasonal circulation patterns of the Yellow and East China Seas derived from satellite-tracked drifter trajectories and hydrographic observations, Prog. Oceanogr. 146, 121-141.
[https://doi.org/10.1016/j.pocean.2016.06.004]

- Lim, D.B. 1976, The movements of the waters off the south coast of Korea. J. Oceanol. Soc. Korea, 11(2), 77-88.
-
Liu, X., Xiao, W., Landry, M.R., Chiang, K.P., Wang, L. and Huang, B. 2016, Responses of phytoplankton communities to environmental variability in the East China Sea, Ecosys. 19(5), 832-849.
[https://doi.org/10.1007/s10021-016-9970-5]

-
MacKenzie, L., Sims, I., Beuzenberg, V. and Gillespie, P. 2002, Mass accumulation of mucilage caused by dinoflagellate polysaccharide exudates in Tasman Bay, New Zealand, Harmful Algae, 1(1), 69-83.
[https://doi.org/10.1016/S1568-9883(02)00006-9]

-
McNaughton, S.J. 1968, Structure and function in California grassland. Ecol. 49(5), 962-972.
[https://doi.org/10.2307/1936547]

- Omura, T., Iwataki, M., Borja, V.M., Takayama, H. and Fukuyo, Y. 2012, Marine Phytoplankton of the Western Pacific. Kouseisha Kouseikaku, Tokyo.
-
Orsini, L., Procaccini, G., Sarno, D. and Montresor, M. 2004, Multiple rDNA ITS-types within the diatom Pseudo-nitzschia delicatissima (Bacillariophyceae) and their relative abundances across a spring bloom in the Gulf of Naples, Mar. Ecol. Prog. Ser. 271, 87-98.
[https://doi.org/10.3354/meps271087]

-
Parsons, T.R., Takahashi, M. and Hargrave, B. 1984, Biological Oceanographic Processes (3rd eds). Pergamon Press, Oxford.
[https://doi.org/10.1016/B978-0-08-030765-7.50010-6]

-
Ryther, J.H. 1969. Photosynthesis and fish production in the sea, Sci. 166(3901), 72-76
[https://doi.org/10.1126/science.166.3901.72]

-
Schurr, J.M. and Ruchti, J. 1977, Dynamics of O2 and CO2 exchange, photosynthesis, and respiration in rivers from time-delayed correlations with ideal sunlight. Limnol. Oceanogr. 22(2), 208-225.
[https://doi.org/10.4319/lo.1977.22.2.0208]

- Shannon, C.E. and Weaver, W., 1963, The mathematical theory of communication. Univ. Illinois, Press, Urbana.
-
Sieracki, M.E., Gifford, D.J., Gallager, S.M. and Davis, C.S. 1998, Ecology of a Chaetoceros socialis Lauder patch on Georges Bank: Distribution, microbial associations, and grazing losses, Oceanogr. 11(1), 30-35.
[https://doi.org/10.5670/oceanog.1998.12]

-
Shin, H.H., Jung, S.W., Jang, M.C. and Kim, Y.O. 2013, Effect of pH on the morphology and viability of Scrippsiella trochoidea cysts in the hypoxic zone of a eutrophied area, Harmful Algae, 28, 37-45.
[https://doi.org/10.1016/j.hal.2013.05.011]

-
Uye, S. 2008, Blooms of the giant jellyfish Nemopilema nomurai: a threat to the fisheries sustainability of the East Asian Marginal Seas, Plankton Benth. Res. 3(Suppl.), 125-131.
[https://doi.org/10.3800/pbr.3.125]

-
Wang, H., Hondzo, M., Xu, C., Poole, V. and Spacie, A. 2003, Dissolved oxygen dynamics of streams draining an urbanized and an agricultural catchment, Ecol. Model. 160(1-2), 145-161.
[https://doi.org/10.1016/S0304-3800(02)00324-1]

-
Xiao, W., Zeng, Y., Liu, X., Huang, X., Chiang, K.P., Mi, T., Zhang, F., Li, C., Wei, H., Yao, Q. and Huang, B. 2019, The impact of giant jellyfish Nemopilema nomurai blooms on plankton communities in a temperate marginal sea, Mar. Poll. Bull. 149, 110507
[https://doi.org/10.1016/j.marpolbul.2019.110507]

- Yang, S.K. 1994. variations of the sea surface temperature distribution and the shelf fronts in the Cheju Strait and the Korea Strait. J. Korean Environ. Sci. Soc. 3(20), 111-128.
-
Yoder, J.A. and Kennelly, M.A. 2003, Seasonal and ENSO variability in global ocean phytoplankton chlorophyll derived from 4 years of SeaWiFS measurements, Global Biogeoch. Cycles, 17(4), 1112.
[https://doi.org/10.1029/2002GB001942]

- Yoon, Y.H. 2010, Red Tides -Uprising of Sea-, Jibmundang, Seoul.
-
Yoon, Y.H. 2013, Vertical profiles of marine environments and micro-phytoplankton community in the continental slope area of the East China Sea in early summer 2009. J. Korean Soc. Mar. Environ. Energy, 16(3), 151-162.
[https://doi.org/10.7846/JKOSMEE.2013.16.3.151]

- Yoon, Y.H. 2011, Marine Environments and Phytoplankton in the South-western Sea of Korea. in: Choi, C.K. (Ed), The Plankton Ecology in Korean coastal waters. Donghwa Pub. Seoul, 68-93.
- Yoon, Y.H. and Koh, N.P. 1994, Distribution of microalgae (phytoplankton) in the coastal waters of Kumo Islands, Southern Korea in summer, Rep. Korean Assoc. Conser. Nat. (KACN), 32, 161-171.
-
Yoon, Y.H., Park, J.H.. Lee, H.J. and Soh, H.Y. 2020, Characteristics of ecological structure and spatial distribution of micro-plankton in relation to water masses in the northern East China Sea(nECS) in summer 2019, Korean J. Environ. Biol. 38(3), 355-370.
[https://doi.org/10.11626/KJEB.2020.38.3.355]

-
Yoon, Y.H., Park, J.S. and Kim, B.S. 2019, Spatial distributions of phytoplankton community in the coastal waters of South Sea, Korea during the early summer of 2018, Korean J. Environ. Biol. 37(2), 164-176.
[https://doi.org/10.11626/KJEB.2019.37.2.164]

- Yoon, Y.H., Park, J.S., Park, Y.G. and Noh, I.H. 2007, Marine environment and the distribution of phytoplankton community in the southwestern sea of Korea in summer 2005, J. Korean Soc. Mar. Environ. Energy, 10(3), 155-166.
- Yoon, Y.H., Park, J.S., Soh, H.Y. and Hwang, D.J. 2003, Spatial distribution of phytoplankton community and red tide of dinoflagellate, Prorocentrum donghaience in the East China Sea during early summer, Korean J. Environ. Biol. 21(2), 132-141.
- Yoon, Y.H., Park, J.S., Soh, H.Y. and Hwang, D.J. 2005. On the marine environment and distribution of phytoplankton community in the northern East China Sea in early summer 2004. J. Korean Soc. Mar. Environ. Energy, 8(2), 100-110.
-
Zhong, F., Xiang, R., Yang, Y. and Zhao, M. 2018, Evolution of the Southern Yellow Sea cold water mass during the last 7 kyr from benthic foraminiferal evidence, Sci. China Earth Sci. 61(10), 1406-1418.
[https://doi.org/10.1007/s11430-017-9193-6]