해양생물에 대한 부유물질 영향평가 방법 및 임계농도에 대한 고찰
초록
건설자원으로 사용되는 바다골재의 채취 행위는 해양환경 내 부유물질을 증가시키며 수산자원에 악영향을 미친다. 하지만 바다골재 채취행위로 인해 증가된 부유물질이 해양생태계에 미치는 영향에 관한 연구는 미흡한 실정이다. 본 연구에서는 부유물질에 대해 수서생물을 이용한 생물영향평가에서 활용되는 주요 종말점(endpoint)과 임계농도를 확인하기 위해 관련 연구를 수집하여 분석하였다. 주요 실험 생물 분류군은 크게 3개의 분류군으로, 척추동물(58%), 무척추동물(38%), 조류(4%) 순으로, 종말점은 아치사반응(50%), 치사(30%), 행동반응(20%) 순으로 많은 연구가 수행되었다. 척추동물(어류)에서는 아치사반응 중 산소소비율, 행동반응에서는 먹이섭취율(부어류), 회피반응(저어류)이 주로 관찰되었다. 무척추동물의 치사반응에서는 사망률, 개체군 감소, 번식률, 알 생산율, 부화율, 아치사반응에서는 산소소비율, 삼투압, 성장저해율이 주로 측정되었고, 조류에서는 개체군 감소만 보고되었다. 최소영향농도의 범위로 보았을 때, 전체 분류군 중 요각류가 부유물질에 가장 민감하였고(100–1000 mg L-1), 상대적으로 어류에서 성장단계별 민감도의 차이가 크게 나타났다. 또한 동일한 분류군에서 종간 영향 차이가 나타났으며, 특히 조류에서 상대적으로 큰 차이를 보였다. 전반적으로, 본 연구에서는 기존의 부유물질 영향 평가에 주로 사용된 연구 종말점, 대표 시험종, 최소영향농도를 확인하였고, 이는 향후 부유물질 생물영향실험에 있어 기초자료로 활용될 수 있을 것으로 기대된다.
Abstract
Marine sand mining for construction resources increases suspended solids in the marine environment, causing adverse effects on fishery resources. However, criteria for suspended solids in the marine ecosystem are insufficient. In this study, documents were collected and analyzed to identify the major experimental endpoint and threshold concentration in the biological impact assessment on aquatic organisms for suspended solids. The main experimental taxa were vertebrates (58%), invertebrates (38%), and algae (4%). In terms of experimental endpoints, research on sub-lethal effect was mostly performed (50%), followed by a lethal (30%) and behavioral response (20%). The oxygen consumption rate in sub-lethal endpoint and the feeding rate (pelagic fish) and evasion (demersal fish) in behavioral response were mainly observed in vertebrates (fish). In invertebrates, the lethal study was mainly performed including mortality, reduced population, reproductive rates, egg production rates, and hatchability. Oxygen consumption rate, osmotic pressure, and reduced growth rate were major endpoints in the sub-lethal effect of invertebrates. The reduced population was the only endpoint assessed for algae (phytoplankton). In threshold concentration, copepods were the most sensitive to suspended solids (100–1000 mg L-1) among all taxa, and a relative difference in sensitivity was great by life stage in fish. In addition, differences in impacts between species in the same taxon were great, especially in algae showed a relatively great difference. Overall, in this study, major endpoints, representative experimental species, and threshold concentrations mainly used to evaluate the effects of suspended solids were identified. The results of this study are expected to provide baseline data for experiments on the effects of suspended solids.
Keywords:
Suspended solids, Endpoint, Vertebrate, Invertebrate, Algae키워드:
부유물질, 종말점, 척추동물, 무척추동물, 조류1. 서 론
부유물질은 담수 유입, 조류, 파랑, 태풍, 홍수 등과 같은 자연현상과 해안개발, 선박을 이용한 운송, 준설, 골재채취, 어업활동 등과 같은 인위적 활동으로 발생한다. 부유물질은 물에 용해되지 않으면서 입자 크기가 2 mm 이하의 수층 내에서 부유하는 물질로, 수층 내에서 장기간 부유하며 수질오염의 주요 원인 중 하나로 지난 수십 년간 지속적으로 연구되어왔다(Waters[1995]; Bilotta and Brazier[2008]; Gordon and Palmer[2015]). 부유물질 발생은 빛의 투과율 감소, 온도변화, 지형변화와 같은 물리적인 변화와 pH 변동, 오염물질과 영양염의 방출과 같은 화학적 변화를 야기하며 발생량과 기간에 따라 수생태계에 장단기 영향을 미칠 수 있다(Dawson and Macklin[1998]; Kronvang et al.[2003]; Miller[1997]; Harrod and Theurer[2002]; Haygarth et al.[2006]; Russell et al.[1998]).
해양생태계 내 부유물질은 일반적으로 배경 농도 수준으로 존재하다가 여러 원인에 의해 고농도로 급격히 증가한다. 지롱드 강 하구(Gironde estuary)와 북해 남부에서는 각각 자연적 발생과 준설에 의해 최대 탁도 4,000 mg L-1(Doxaran et al.[2009]; Fettweis et al.[2011]), 체사피크만(Chesapeake Bay)에서는 준설로 탁도가 최대 100,000 mg L-1까지 상승한다고 보고된 바 있다(Nichols et al.[1990]). 고농도의 부유물질은 해양생물 전반에 다양한 악영향을 미친다. 미세조류는 부유물질 노출로 성장 저해 영향이 보고되었고(Quinn et al.[1992]), 무척추동물에서는 이동 비율 증가, 서식밀도 감소, 종 다양성 및 풍부도 감소, 생식 감소, 아가미와 내장 손상 등의 영향이 보고되었다(Nuttall and Bielby[1973]; Rosenberg and Wiens[1978]; Wagener and Laperriere[1985]; Quinn et al.[1992]; Shaw and Richardson[2001]). 어류에서는 치사율 증가, 회피율 증가, 수정률 감소, 먹이 섭식률 및 면역 저하, 아가미 손상 등을 일으키는것으로 알려져있다(Herbert et al.[1961]; Slaney et al.[1977]; Stober et al.[1981]; Reynolds et al.[1988]; Lake and Hinch[1999]; Shaw and Richardson [2001]; Robertson et al.[2007]). 부유물질 영향 및 생태위해성 평가가 지속되고 있지만 주로 수산가치가 높은 생물 위주로 연구가 수행되었고, 국외에서도 수산가치가 높은 연어나 송어 같은 담수어류에 관한 연구가 중점적으로 수행되었다(Goldes et al.[1988]; Newcombe and Jensen[1996]; Wilber and Clark[2001]). 상대적으로 해산어류에 대한 연구와 생물의 성장단계별 부유물질 노출 영향에 대한 연구가 미비한 상태였다.
국내에서 부유물질이 발생하는 주원인은 준설, 바다골재채취, 해상에서의 대규모 공사로 알려져 있다(MOF[1999]; Kim and Lim[2009]; Seo et al.[2018]). 양식 어가에서는 다양한 요인에 의해 발생한 부유물질로 인해 양식 및 어업에 피해가 있다고 주장하고 있다. 하지만 부유물질이 해양생물에 미치는 영향은 해양 환경 내 수온, 염분, 오염물질과 같은 환경요인과 적조와 같은 생물학적 요인들이 동시에 영향을 미치기에 정량적인 평가가 어려운 실정이다(Kim et al.[2007]). 국내에서는 주요 해산 양식어종인 넙치, 조피볼락, 돌돔과 패류 중 대합, 동죽, 가무락조개와 수산생물의 먹이원인 동물플랑크톤에 대해 부유물질 노출 연구가 수행되었다(Chang and Chin[1978]; Yoon and Park[2011]; Chu et al.[2020]). 하지만 기존 연구들에서 사용한 실험 방법이나 종말점이 상이하고, 전체적인 연구 수가 부족한 실정이다. 국외에서는 부유물질 농도에 수질기준을 설정하여 주로 담수 생태계를 보호하고 있다(Table 1). 캐나다에서는 유량(저유량, 고유량)별로 노출 시간(24시간 또는 24시간에서 30일)에 따른 기준값, 미국에서는 광합성 보상점 깊이, EU에서는 예외적인 기상상황을 제외하고는 동일한 기준값, 호주와 뉴질랜드에서는 지역 및 지대별로 각기 다른 기준값을 사용하고 있다(ANZECC[2000]; EU[2006]; CCME[2007]; US EPA[2007]). 향후 국내에서도 이와같이 부유물질에 대한 생물 영향이 관리되기 위해서는 분류군 별로 동일한 실험방법과 주요 시험종(성장단계별)에 대한 연구 결과가 필요한 상황이다.

Summary of water quality guidelines for suspended solids in the United States, Canada, European Union, Australia, and New Zealand
따라서 본 연구의 목적은 1) 부유물질의 생물영향이 확인된 종말점(endpoint)과 임계농도를 분석하고, 2) 실험에 사용된 시험종 및 성장단계를 파악하여, 부유물질의 영향 평가에 주로 사용되는 주요 종말점, 임계농도, 성장단계 별 시험종을 확인하는 것이다. 본 연구의 결과는 향후 부유물질에 대한 생물영향실험에서 시험종 및 종말점 선정에 있어 기초자료로 활용될 수 있을 것으로 기대된다.
2. 재료 및 방법
본 연구에서는 출판된 문헌 중 부유물질의 생태영향이 보고된 연구문헌을 수집 후 분석하였다. 부유물질의 영향이 확인된 98편의 문헌을 확인하여 분석에 사용하였고, 결과 및 고찰 3.1에서는 연구수를 개별 문헌의 주요 실험 분류군(척추동물, 무척추동물, 조류) 및 종말점(치사, 아치사반응, 행동반응) 당 1건으로 계산하였다. 결과 및 고찰 3.2–3.4에서는 연구 수를 개별 문헌의 세부 분류군(저어류, 부어류, 이매패류, 새우류, 게류, 지렁이류, 요각류, 윤충류, 식물플랑크톤)에서 세부 종말점(endpoint)(치사율, 산소소비율, 성장률, 표피손상, 먹이 섭식률, 회피반응 등) 당 각 1건으로 계산하였다. 어류의 경우 수괴 내 저층과 표층에서 부유물질의 영향관계를 확인하기 위해 저어류와 부어류로 구분하여 분석을 진행하였다. 또한 일반 부유물질과 오염된 부유물질의 생물영향을 구분하여 분석하였다. 오염된 부유물질의 연구가 거의 수행되지 않았기 때문에 결과 및 고찰 3.2–3.4에서는 일반 부유물질의 영향 결과만이 제시되었다.
3. 결과 및 고찰
3.1 주요 실험 군 및 종말점
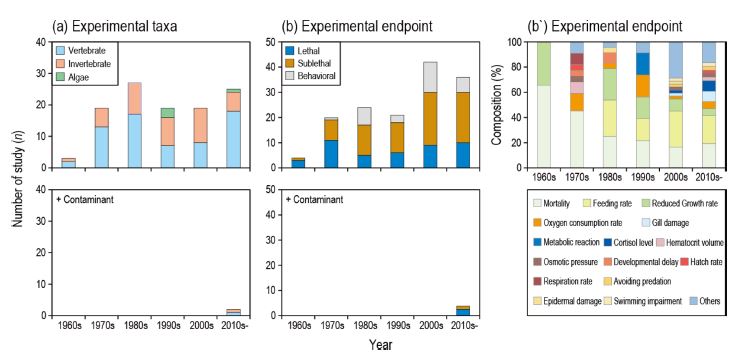
부유물질의 생물영향연구는 1960년대부터 1980년대까지 지속해서 증가하다가 1990–2000년대에 감소하였고, 이후 다시 2010년대부터는 많은 연구가 이루어졌다(Fig. 1). 가장 많이 연구된 실험생물은 척추동물(67건), 무척추동물(50건), 조류(3건) 순이었다. 척추동물에 대한 생물영향연구는 전체적인 경향과 비슷하게 1950년대부터 시작되었고, 1980년대(17건)와 2000년대(18건)에 많이 연구되었다. 무척추동물에 대한 생물영향연구는 1960년대부터 시작되었고, 1980년대까지 연구 수가 증가하다가 이후 점차 감소하는 경향을 보였다. 조류에 대한 생물영향 연구는 1990년대 들어서 수행되었다. 전반적으로 부유물질의 생물영향연구는 주로 척추동물과 무척추동물에 집중되어 있었고, 조류에 대한 영향 연구가 적었다.
Major (a) experimental taxa and (b) experimental endpoint of studies which are reported significant effects of suspended sediment by period.
부유물질의 생물영향연구 종말점은 1950년대부터 최근까지 지속적으로 다변화되는 경향을 보였다. 크게 3가지(치사, 아치사반응, 행동반응)로 구분한 종말점은 아치사반응 연구가(75건) 가장 많이 수행되었고, 치사(47건), 행동반응(28건) 연구순으로 연구가 많이 수행되었다(Table 2). 시기적으로는 치사, 아치사반응 연구는 1960년대, 행동반응은 1970년대부터 연구가 시작되었고 이후 지속적으로 증가하는 경향을 보였다. 특히 2000년대 이후에는 이전 시기보다 분류군 별 연구 수에 비해 종말점 연구 수가 상대적으로 더 많이 증가하였고, 이는 개별 연구에서 다양한 종말점으로 부유물질의 생물영향을 평가하고 있는 것을 나타낸다. 최근에는 부유물질과 용존상태의 오염물질이 동시에 작용하는 상황을 가정한 혼합독성 영향연구가 수행된 바 있으나, 복합작용에 대한 해석의 어려움 등으로 인해 매우 적은 수의 연구만 수행되었다.
3.2 척추동물에 대한 부유물질 영향 평가 및 연구 종말점
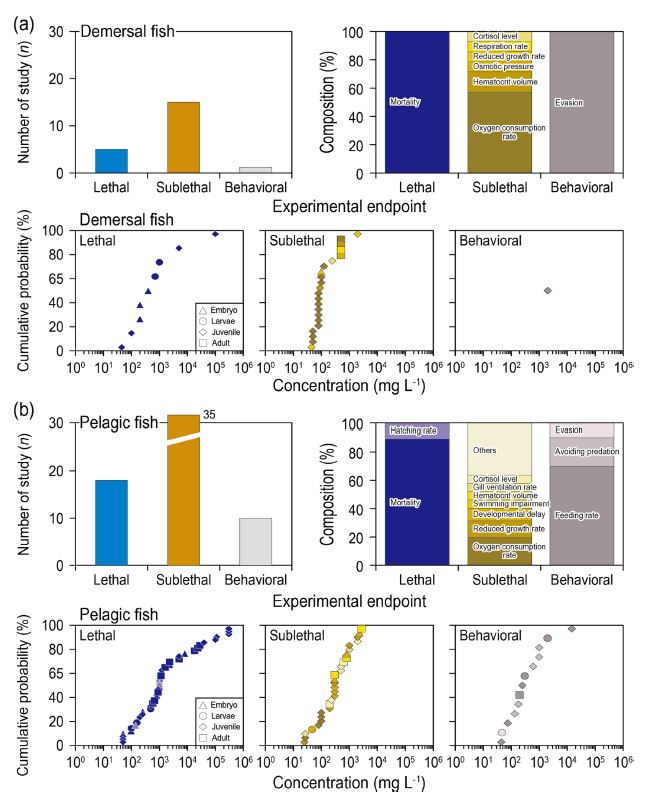
척추동물(어류)에 대한 세부 종말점별 연구 수는 총 67건이었고, 그중 저어류가 16건, 부어류가 51건이었다(Fig. 2). 부어류를 이용한 연구 사례가 많은 것은 상대적으로 종의 다양성이 풍부하여 생태영향평가에서 선호되는 경향이 있으며, 또한 실험이 용이한 부분이 고려된 것으로 판단된다. 저어류와 부어류에 대한 연구는 모두 아치사반응 연구가 가장 많았고, 치사와 행동반응 순으로 연구가 많이 수행되었다. 저어류에 대한 아치사반응 주요 종말점은 산소소 비율(8건), 적혈구 용적률(2건)이었다. 산소소비율은 생물의 에너지 대사를 측정하는 대표적인 종말점으로 연속적으로 정량화된 값으로 에너지 대사를 평가할 수 있다(Jobling[1982]; Lefevre et al.[2015]; Liu[1997]). 적혈구 용적률은 적혈구 증가 및 빈혈의 정도를 파악하는 척도로써, 조직 및 장기의 기능 저하를 예측할 수 있는 것으로 알려져 있다(Jones et al.[1997]). 그 외 아치사반응 종말점은 삼투압, 성장저해율, 호흡률, 코르티솔 농도 등이 있었다. 저어류에 대한 치사 연구는 치사율(5건)에 대한 연구만 보고되었고, 행동반응 영향은 회피반응(1건)에 대한 연구만이 보고되었다. 치사, 아치사 반응 연구에서 최소영향농도의 범위는 각 45–10,000 mg L-1와 45–2,000 mg L-1였고, 아치사반응 중 가장 민감한 종말점은 산소소비율(50–500 mg L-1), 둔감한 종말점은 성장률이었다(45–2,000 mg L-1). 대부분의 종말점에서 상대적으로 어린 성장단계일수록 부유물질 영향에 민감한 것이 확인되었고, 이는 가장 민감한 성장단계를 선택해 실험이 필요함을 의미한다.
Number of study, composition of detailed experimental endpoint, and cumulative probability of threshold concentration of (a) demersal fish and (b) pelagic fish.
부어류에 대한 아치사반응은 저어류에 비해 다양하게 보고되었다. 가장 많이 측정된 항목은 산소소비율(9건)과 성장저해율(6건)이었고, 발달지연(3건), 유영저해, 코르티솔 농도, 적혈구 용적률, 아가미 개폐율이 각 2건 순으로 많은 연구가 이루어졌다. 수중에서 부유물질 농도의 증가는 어류의 시야를 감소시키고, 먹이섭취율을 저해하여 성장에 영향을 미칠 가능성이 높아진다(Wenger et al.[2012]). 어류의 성장 감소는 포식자에게 유리하게 작용하여 치사율을 높일 수 있기 때문에 발달지연은 중요한 종말점 중 하나로 볼 수 있다(Holmes and McCormick[2010]; Sirois and Dodson[2000]). 치사 연구는 사망률 15건, 부화율에 대한 연구가 2건 수행되었다. 배아가 부화하는 시기는 어류의 생활사 중 가장 민감한 시기로 부유물질 영향 스트레스를 관찰하기 적합하다(Park et al.[2002]). 행동반응은 먹이섭취율이 가장 많이 보고되었고(7건), 포식회피와 회피반응이 각 2건과 1건 보고되었다. 치사, 아치사, 행동반응 연구에서 최소영향농도의 범위는 각 50–300,000 mg L-1, 25–2,000 mg L-1, 44–14,600 mg L-1로 나타났다. 아치사연구에서 종말점은 산소소비율, 유영 저해가 가장 민감하였고, 발달시간 지연이나 적혈구용적 변화에서는 둔감한 반응이 나타났다. 행동반응에서는 회피반응이 가장 민감하였고, 먹이섭취율에서는 둔감한 반응을 보였다. 저어류와 동일하게 상대적으로 어린 성장단계일수록 민감한 반응을 보였고, 이는 배아, 자치어가 주변환경에 더 높은 민감도를 가지는 것을 암시한다.
부유물질에 대한 영향을 평가한 어류의 시험종 중 저어류는 넙치(Paralichthys olivaceus)가 10건으로 가장 많은 연구가 이루어졌고, 조피볼락(Sebastes schlegelii)이 4건, 쥐노래미(Hexagrammos otakii)가 2건 연구되었다. 넙치, 조피볼락은 한국, 일본, 중국 연안에 서식하는 주요 수산 어종이고, 쥐노래미도 동아시아에 주로 서식하는 연안 정착성 어류이다. 이들 종에 대한 연구는 주로 국내에서 수행되었다(Chu et al.[2020]; Yoon and Park[2011]). 부어류는 줄농어(Morone saxatilis)가 15건으로 가장 많았고, 무지개송어(Salmo gairdneri)가 14건, 농어과의 일종인 Epinephelus coioides가 10건, 태평양청어(Clupea pallasi)가 9건 순으로 많이 보고되었다. 상대적으로 연구가 많이 수행된 부어류는 대부분 기수지역에 서식하는 종으로 하구역의 거센 물살에 의해 발생하는 부유물질에 대한 영향을 평가한 논문이 대부분이다(Au et al.[2020]; Auld and Schubel[1978]; Breitburg[1988]; Herbert et al.[1961]; Ross et al.[1985]). 따라서 외해역 해사채취 시 발생하는 부유물질의 생물 영향을 평가하기 위해서는 해당 지역의 서식 어종으로 실험이 진행되어야 할 것으로 판단된다. 발달단계별로 보았을 때 부어류는 저어류에 비해 여러 발달단계를 포함하는 연구가 선행되었다. 예를들어 성장률은 한 건을 제외하고 모두 치어와 배아/자어를 대상으로 실험을 진행하였고, 성장률은 대부분 7일 이내의 노출 기간을 설정하여 급성영향을 평가하였다. 일반적으로 부유물질에 노출된 어류는 동일 종일지라도 연령에 따라 민감도가 다른 것으로 알려져 있다(Sutherland and Meyer[2007]). 따라서 생물영향에 대한 부유물질의 영향을 판단할 때에는 다양한 어종 외에도 어류의 생활사를 고려하는 등 다양한 시나리오를 고려하여 영향평가가 수행되어야 한다.
3.3 무척추동물에 대한 부유물질 영향 평가 및 종말점
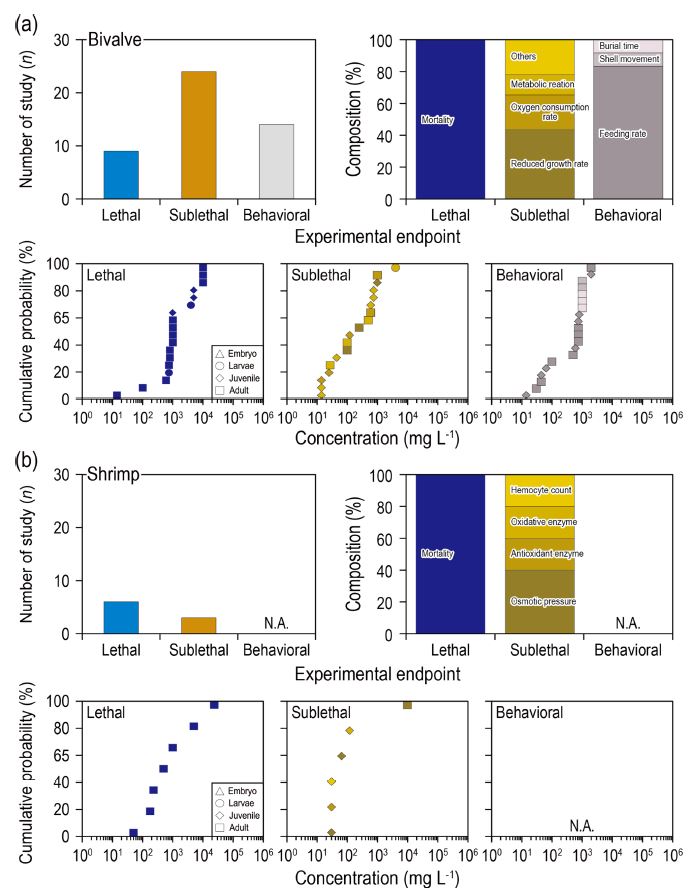
무척추동물에 대한 연구 수는 총 50건으로, 이매패류에 대한 연구가 28건으로 가장 많았고, 새우류(8건), 요각류(6건), 게류(4건), 다모류 (2건), 윤충류(2건) 순으로 많은 연구가 진행되었다. 이매패류에서는 아치사반응에 대한 연구가 가장 많았고, 행동반응과 치사순으로 많은 연구가 수행되었다(Fig. 3). 아치사반응 중 가장 많이 연구된 종말점은 성장저해율(10건)이었고, 산소소비율(5건), 대사반응(3건) 순으로 많은 연구가 수행되었다. 성장저해율은 실험구와 대조구의 성장률을 비교함으로써 노출물질로 인한 성장장애를 평가하는 보편적인 방법이고, 산소소비율과 대사반응은 에너지 대사를 측정하여 정량화하는 방법이므로 생물영향을 평가하는데 이점이 있다. 그 외 연구는 핵산비율, 혈액 특성, 오염물질 축적률, 글리코겐 함량 등(각 1건), 스트레스 노출 시 생리학적 반응을 민감하게 평가하는 방법들이 사용되었으나 아직 연구 수가 부족한 실정이다. 부유물질에 대한 이매패류의 성장 영향은 부유물질의 유형 및 농도와 종에 따라 긍정적 또는 부정적 영향을 미칠 수 있기 때문에 생리 반응 중에서 가장 많이 연구된 것으로 판단된다(Bricelj et al.[1984]). 치사 연구는 모두 치사율에 대한 내용이었으며, 행동반응은 먹이섭취율이 11건, 패각 움직임(단위시간당 패각이 여닫는 횟수), 퇴적물 잠입 시간이 각 1건 보고되었다. 먹이섭취율에 대부분 연구가 집중된 것은 퇴적물에 잠입하여 생활하는 이매패류의 특성이 고려된 것으로 판단된다.
Number of study, composition of detailed experimental endpoint, and cumulative probability of threshold concentration of (a) bivalve and (b) shrimp. N.A. indicates not analyzed.
새우류는 치사 연구가 가장 많이 수행되었고, 아치사반응은 삼투압, 산화효소, 항산화효소활성, 혈액세포 수가 각 1건씩 보고되었다(Fig. 3). 게류에서는 아치사반응, 치사, 행동반응 순으로 연구가 많이 수행되었다(Fig. 4). 게류의 아치사반응 영향은 산소소비율, 영양분 흡수능력, 에너지 수지에 대한 연구가 1건씩 보고되었고, 행동반응 영향은 먹이섭취율이 1건 보고되었다. 다모류의 경우에는 치사 연구만 2건으로 사망률과 개체군 감소가 보고되었다(Fig. 4). 삼투압은 부유물질 영향으로 인한 스트레스로 이온 흡수와 수분 손실과 같은 영향을 측정할 수 있다고 알려져 있다(Kathyayani et al.[2021]). 또한 산화효소와 항산화효소 활성은 환경스트레스 노출에 대한 반응을 평가하는 지표로 활용되며, 에너지 수지와 영양분 흡수능력은 생물의 성장을 생리적으로 평가하는 유용한 방법이다(Kathyayani et al.[2021]; Steger and Gardner [2007]). 새우류와 다모류에서는 아치사반응이나 행동반응 연구가 수행되지 않았는데, 향후 부유물질에 의한 스트레스 반응으로 물리적, 생리적 변화를 측정하기 위해 아치사반응 또는 행동반응에 대한 연구가 필요하다고 판단된다.
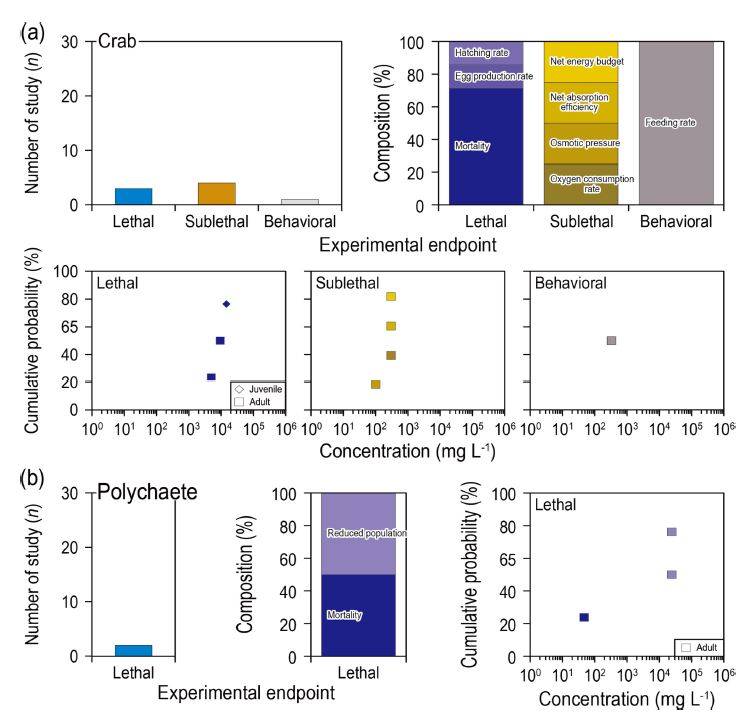
Number of study, composition of detailed experimental endpoint, and cumulative probability of threshold concentration of (a) crab and (b) polychaete.
이매패류, 새우류, 게류, 다모류의 치사 연구에서 최소영향농도의 범위는 각 14–10,000 mg L-1, 50–24,000 mg L-1, 5,000–15,900 mg L-1, 48–25,000 mg L-1로, 게류를 제외하고는 대부분 비슷한 영향범위를 보였다. 아치사 연구에서 민감한 종말점은 산소소비율과 삼투압으로 나타났고, 행동반응 연구에서 가장 민감한 종말점은 먹이섭취율로 나타났다. 성장단계별 민감도의 차이는 어류에 비해 덜 민감한 것으로 나타났는데, 이는 대부분의 실험이 성체와 미성숙체 성장단계에서 실험이 수행되었고, 어류에 비해 미성숙체와 성체의 생리적 변화가 크지 않은 결과로 예상된다.
요각류는 치사 4건, 행동반응이 3건 연구되었다. 치사 연구는 치사율(2건), 부화율(1건), 알 생산율(1건) 순으로 연구가 많이 수행되었고, 행동반응은 모두 먹이섭취율(3건)에 관한 연구였다(Fig. 5). 윤충류에 관한 연구는 1건으로 치사 연구로 개체군 감소 연구가 수행되었다(Fig. 5). 알 생산율과 수정란 부화율은 부유물질 노출로 인한 양질의 먹이 섭취 제한 영향을 평가할 수 있는 방법으로 알려져 있다(Kang [2012]). 대부분의 동물플랑크톤 연구는 치사와 아치사반응 연구만이 수행되었는데, 이는 부유생물이 다른 생물에 비해 생활사가 짧고 발달 단계 관찰이 용이하기 때문이다(Zheng et al.[2017], Lee et al.[2008]). 행동반응에 대한 연구는 거의 수행되지 않았는데, 이는 부유물질에 노출된 상태에서 상대적으로 크기가 작은 부유생물의 행동반응을 정량적으로 평가하기 어렵기 때문으로 판단된다. 요각류의 치사, 아치사, 행동반응 연구에서 최소영향농도의 범위는 각 100–1,000 mg L-1, 1,000–5,000 mg L-1, 100 mg L-1 였고, 먹이 섭식률이 가장 민감한 종말점으로 나타났다. 윤충류의 치사 연구에서 최소영향농도의 범위는 100–10,000 mg L-1 요각류보다 넓은 범위를 보였다. 다른 분류군과 비교하였을 때, 요각류와 윤충류는 부유물질 영향에 가장 민감한 것으로 나타났다. 따라서 향후 부유물질 영향평가시 요각류와 윤충류는 시험종으로 먼저 고려되어야 한다고 판단된다.
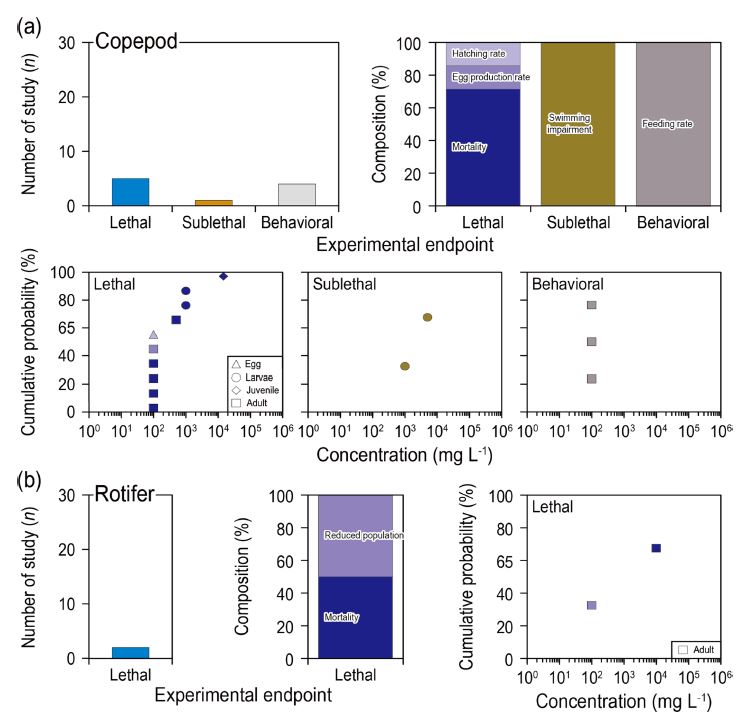
Number of study, composition of detailed experimental endpoint, and cumulative probability of threshold concentration of (a) copepod and (b) rotifer.
이매패류 중 가장 실험에 많이 사용된 종은 북미에 서식하는 대합조개(Mercenaria mercenaria)로 총 7건이 보고되었고, 성체와 유생단계 모두 연구가 수행되었다. 뒤를 이어 국내에 주로 서식하는 백합(Meretrix lusoria)(5건), 동죽(Mactra veneriformis)(4건)에 대한 연구가 주로 수행되었고(Chang and Chin[1978]; Lee et al.[1994]), Austrovenus stutchburyi(백합과)와 Mya arenaria(우럭조개)의 경우는 각 4건, 3건으로 성패와 치패에 대해 연구가 수행되었다. 보고된 시험종이 대부분 국내에 주로 서식하는 종이므로, 향후 국내 기준을 마련할 때 이러한 대표종들의 결과가 고려되어야 한다. 새우류는 Crangon nigricauda(자주새우속)와 흰다리새우(Penaeus vannamei) 가 각 2건씩 수행되었고, 그 외에 종들은 각 1건씩 연구가 보고되었다. 새우류의 연구는 보리새우(Penaeus japonicus) 1건을 제외하고 모두 성하로만 연구가 수행되어 배아/유생 및 치하기에 대한 연구가 전무하였다. 시험종 중 흰다리새우는 국내에서 중요한 양식 종이고, 보리새우는 수산가치가 높은 생물로 향후 새우류에 대한 국내기준 마련 시 두 종에 대한 결과가 우선적으로 고려되어야 한다. 게류는 민꽃게(Charybdis japonica), 대짜은 행게(Cancer magister)와 Petrolisthes elongatus(게붙이과)가 시험종으로 사용되었고, 시험종 중 국내에 서식하는 종은 민꽃게 1종이었다. 다모류는 Naididae sp.(물지렁이과), Tubificidae sp.(실지렁이과), Alitta succinea(참갯지렁이과)에 대한 연구가 수행되었다. 전반적으로, 이매패류와 새우류에서만 다양한 종으로 실험이 수행되었기 때문에, 종에 따른 영향차이와 국내에 주로 서식하는 종에 대한 영향을 평가하기 위해 게류와 다모류에 대해서는 추가적인 연구가 필요하다고 판단된다.
무척추동물 중 요각류에서는 Paracalanus sp.가 5건으로 가장 많이 보고되었고, Tigriopus japonicus, Acartia sp.가 각 1건씩 보고되었다. Paracalanus 속에 해당하는 요각류는 한국 연안에서도 많이 서식하는 것으로 알려져 있으며, Paracalanus parvus, P. aculeatus, P. crassirostris, P. gracilis로 총 4종이 보고된 바 있다(Kang[1996]). Tigriopus japonicus는 국내에 서식하는 대표 저서성 요각류이고, Acartia 속 또한 한국 연안에서 많이 서식하며 Acartia hongi, A. ohtsukai 등이 우점하여 출현하는 것으로 알려져 있다(Seo et al.[2018]). 윤충류에서는 전 세계적으로 서식하는 Brachionus plicatilis로 수행된 연구 1건이 보고되었다. 요각류의 짧은 생활사를 고려해 알 생산력과 부화율에 관한 연구가 수행되었는데, 생활사가 짧고 알 관찰이 가능한 윤충류에서도 이와 같은 종말점에 대한 평가가 가능할 것으로 예상된다.
3.4 조류에 대한 부유물질 영향 평가 및 연구 종말점
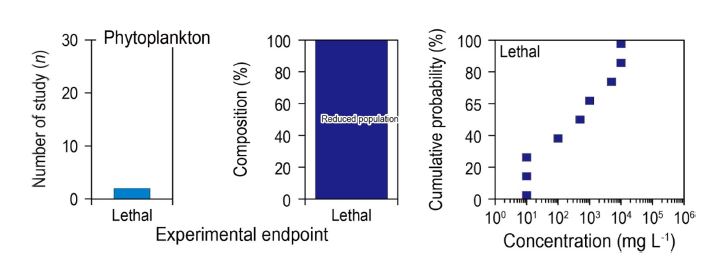
조류에 대한 연구 수는 총 2건으로 미세조류의 개체군 감소에 대한 연구만이 보고되었다(Fig. 6). 아치사반응과 행동반응에 대한 연구는 수행되지 않았는데, 이는 부유물질에 노출된 상태에서 미세조류의 생리적 변화를 평가하기 어렵기 때문으로 예상된다. 일반적으로 미세조류의 생리적 평가는 일차생산력, 세포막 변화, 세포 크기, 기형 등의 아치사반응과 활성도와 같은 행동반응에 대한 연구가 주로 수행되고 있어, 향후에는 이와 같은 종말점에 대한 평가가 필요하다고 판단된다(Lee et al.[2020]). 미세조류 시험종은 Dunaliella salina, Fragilaria sp., Heterosigma akashiwo, Isochrysis galbana, Nitzchia sp., Phaeodactylum tricornutum, Skeletonema costatum, Tabellaria sp., Tetraselmis striata 로 9종에 대해 부유물질 영향이 보고되었고, 규조류, 녹조류, 침편모조류, 착편모조류에 대한 연구가 수행되었다. 미세조류의 치사 연구에서 최소영향농도의 범위는 10–10,000 mg L-1로 넓은 범위를 보였다. 규조류 중 Fragilaria sp., Nitzchia sp., Tabellaria sp.가 가장 민감하였고, 착편모조류인 I. galbana가 가장 둔감한 것으로 나타났다. 가장 민감한 3종을 제외한 다른 규조류의 최소영향농도는 5,000–10,000 mg L-1로, 같은 규조류에서도 부유물질 영향에 대한 종별 차이가 크게 나타났다. 향후 미세조류의 아치사, 행동반응과 같은 생리적 기능연구를 통해 이러한 종과 분류군 간의 영향 차이가 규명되어야 할 것이다.
4. 결 론
본 연구에서는 부유물질 영향이 확인된 문헌에서 분류군 별 주요 연구 종말점, 시험종, 최소영향농도를 분석하였다. 여러 분류군 중 부어류에서 가장 많은 연구가 이루어졌고, 연구 종말점에서는 산소소비율, 성장률, 치사율, 먹이섭취율 등이 가장 많이 평가된 것으로 나타났다. 주요 시험종은 모든 분류군에서 수산가치가 높은 종들이거나 일반적으로 널리 분포하는 종이었고, 이는 연구의 활용성 및 효율성을 고려한 결과로 판단된다. 지난 수십 년간 해양생물에 대한 부유물질 영향 평가 연구가 수행되었지만, 대부분의 연구가 척추동물과 무척추동물 중 이매패류에 치중되어 있었다. 또한 다양한 연구 종말점이 보고되었지만, 연구마다 각기 다른 종말점을 평가하는 경우가 많았기에, 부유물질의 영향을 정량적으로 비교하기는 어려울 것으로 예상된다. 모든 시험종과 종말점을 평가하기는 현실적으로 어렵기 때문에, 향후 부유물질의 생물영향실험에서는 분류군 별 대표 종과 대표적인 종말점의 일관된 평가가 이루어져야 할 것이다.
Acknowledgments
본 연구는 해양수산부의 “과학기술기반 해양환경영향평가 기술개발(과제 번호: 20210427)” 과제의 지원을 받아 수행하였습니다.
References
- ANZECC (The Australian and New Zealand Environment Conservation Council), 2000, Aquatic ecosystems-rationale and background information, Chapter 8. Australian and New Zealand Guidelines for Fresh and Marine Water Quality. Paper no. 4, vol. 4. Australian and New Zealand Environment and Conservation Council and Agriculture and Resource Management Council of Australia and New Zealand.
-
Au, D.W.T., Pollino, C.A., Wu, R.S.S., Shin, P.K.S., Lau, S.T.F. and Tang, J.Y.M., 2004, Chronic effects of suspended solids on gill structure, osmoregulation, growth, and triiodothyronine in juvenile green grouper Epinephelus coioides, Mar. Ecol. Prog. Ser., 266, 255-264.
[https://doi.org/10.3354/meps266255]

-
Auld, A. and Schubel, J., 1978, Effects of suspended sediment on fish eggs and larvae: a laboratory assessment, Estuar. Coast. Mar. Sci., 6, 153-164.
[https://doi.org/10.1016/0302-3524(78)90097-X]

-
Awata, S., Tsuruta, T., Yada, T. and Iguchi, K., 2011, Effects of suspended sediment on cortisol levels in wild and cultured strains of ayu Plecoglossus altivelis, Aquaculture, 314(1-4), 115-121.
[https://doi.org/10.1016/j.aquaculture.2011.01.024]

-
Baba, Y., Kawana, K., Handa, T., Iwata, N. and Namba, K., 2006, Eco-physiological effects of suspended soils on fish: Effects of smectite on the survival of the Japanese flounder Paralichthys olivaceus. Bull. Japan. Soc. Sci. Fish., 72, 408-413.
[https://doi.org/10.2331/suisan.72.408]

-
Bacon, G.S., MacDonald, B.A. and Ward, J.E., 1998, Physiological responses of infaunal (Mya arenaria) and epifaunal (Placopecten magellanicus) bivalves to variations in the concentration and quality of suspended particles I. Feeding activity and selection, J. Exp. Mar. Biol. Ecol., 219, 105-125.
[https://doi.org/10.1016/S0022-0981(97)00177-9]

- Bash, J., Berman, C. and Bolton, S., 2001, Effects of turbidity and suspended solids on salmonids, Final research report, Washington State Transportation Center, USA, 1-66.
-
Bilotta, G.S. and Brazier, R.E., 2008, Understanding the influence of suspended solids on water quality and aquatic biota, Water Res., 42(12), 2849-2861.
[https://doi.org/10.1016/j.watres.2008.03.018]

-
Birkett, C., Tollner, E.W. and Gattie, D.K., 2007, Total suspended solids and flow regime effects on periphyton development in a laboratory channel, Trans. Am. Soc. Agric. Engrs., 50(3), 1095-1104.
[https://doi.org/10.13031/2013.23118]

-
Boehlert, G.W., 1984, Abrasive effects of Mount Saint Helens ash upon epidermis of yolk sac larvae of Pacific herring Clupea harengus pallasi, Mar. Environ. Res., 12(2), 113-126.
[https://doi.org/10.1016/0141-1136(84)90017-5]

-
Boehlert, G.W. and Morgan, J.B., 1985, Turbidity enhances feeding abilities of larval Pacific herring, Clupea harengus pallasi, Hydrobiologia, 123(2), 161-170.
[https://doi.org/10.1007/BF00018978]

-
Boubée, J.A.T., Dean, T.L., West, D.W. and Barrier, R.F.G., 1997, Avoidance of suspended sediment by the juvenile migratory stage of six New Zealand native fish species, New Zeal. J. Mar. Fresh., 31(1), 61-69.
[https://doi.org/10.1080/00288330.1997.9516745]

-
Breitburg, D., 1988, Effects of turbidity on prey consumption by striped bass larvae, Trans. Am. Fish. Soc., 117, 72-77.
[https://doi.org/10.1577/1548-8659(1988)117<0072:EOTOPC>2.3.CO;2]

-
Bricelj, V.M., Malouf, R.E. and de Quillfeldt, C., 1984, Growth of juvenile Mercenaria mercenaria and the effect of resuspended bottom sediments, Mar. Biol., 84, 167-173.
[https://doi.org/10.1007/BF00393001]

-
Buermann, Y., Du Preez, H.H., Steyn, G.J. and Smit, L., 1997, Tolerance levels of redbreast tilapia, Tilapia rendalli (Boulenger, 1896) to natural suspended silt, Hydrobiologia, 344(1-3), 11-18.
[https://doi.org/10.1023/A:1002985707694]

- Canadian Council of Ministers of the Environment (CCME), 2007, http://www.ec.gc.ca/ceqg-rcqe/English/ceqg/ default.cfmS.
- Chang, S.D., Chin, P. and Sung, B.O., 1976, Effect of silt and salinity on the mortality of Meretrix lusoria, Kor. J. Fish. Aquat. Sci., 9(1), 69-73.
- Chang, S.D. and Chin, P., 1978, Effect of suspended silt and clay on the mortality of some species of bivalves, Bull. Korean Fish. Soc., 11(4), 227-231.
- Chin, P., Shin Y.K., Kim, H.S. and Chang, O.Y., 1998, Effects of suspended solids on mortality, respiration and feeding behavior of marine animals, Bull. Korean Fish. Soc., 316-317.
- Cho, K.W., Maeng, J.H., Shin, B.S. and Kim, B.J., 2003, Studies on Improvement of Costal Flow and Suspend Predictions in the Coastal Zone Developments, KEI, RE-19, 29-37.
-
Chu, S.O., Lee, C., Noh, J., Kwon, B.-O. and Khim, J.S., 2020, Effects of polluted and non-polluted suspended sediments on the oxygen consumption rate of olive flounder, Paralichthys olivaceus, Mar. Pollut. Bull., 154, 111113.
[https://doi.org/10.1016/j.marpolbul.2020.111113]

- Chung, E.Y., Shin, Y.K. and Lee, J.H., 1994, Effects of suspended sediment on metabolism of Scapharca broughtonii, Kor. J. Malacol., 10, 55-63.
- Davis, H.C. and Hidu, H., 1969, Effects of turbidity producing substances in sea water on eggs and larvae of three genera of bivalve mollusks, The Veliger, 11, 316-323.
-
Dawson, E.J. and Macklin, M.G., 1998, Speciation of heavy metals on suspended sediment under high flow conditions in the River Aire, West Yorkshire, UK, Hydrol. Process., 12, 1483-1494.
[https://doi.org/10.1002/(SICI)1099-1085(199807)12:9<1483::AID-HYP651>3.0.CO;2-W]

-
Doxaran, D., Froidefond, J.M., Castaing, P. and Babin, M., 2009, Dynamics of the turbidity maximum zone in a macrotidal estuary (the Gironde, France): Observations from field and MODIS satellite data, Estuar. Coast. Shelf. Sci., 81(3), 321-332.
[https://doi.org/10.1016/j.ecss.2008.11.013]

-
Du Preez, H.H., Buermann, Y., Steyn, G. and Smit, L., 1996a, The influence of suspended silt on oxygen consumption by the redbreast tilapia, Tilapia rendalli (Boulenger, 1896), Hydrobiologia, 325, 31-38.
[https://doi.org/10.1007/BF00023665]

-
Du Preez, H.H., Smit, L., Steyn, G. and Buermann, Y., 1996b, The effect of sublethal concentrations of natural suspended silt on routine oxygen consumption by Mozambique tilapia (Oreochromis mossambicus), Afr. J. Aquat. Sci., 22(1-2), 81-89.
[https://doi.org/10.1080/10183469.1996.9631374]

-
Ekelund, R., Granmo, A., Berggren, M., Renberg, L. and Wahlberg, C., 1987, Influence of suspended solids on bioavailability of bexachlorobenzene and lindane to the deposit-feeding marine bivalve, Abra nitida (MOiler), Bull. Environ. Contam. Toxicol., 38, 500-508.
[https://doi.org/10.1007/BF01606620]

-
Ellis, J., Cummings, V., Hewitt, J., Thrush, S. and Norkko, A., 2002, Determining effects of suspended sediment on condition of a suspension feeding bivalve (Atrina zelandica): results of a survey, a laboratory experiment and a field transplant experiment, J. Exp. Mar. Biol. Ecol., 267, 147-174.
[https://doi.org/10.1016/S0022-0981(01)00355-0]

- EU, 2006. On the quality of fresh waters needing protection or improvement in order to support fish life. 23-31.
-
Fettweis, M., Baeye, M., Francken, F., Lauwaert, B., Van den Eynde, D., Van Lancker, V., Martens, C. and Michielsen, T., 2011, Monitoring the effects of disposal of fine sediments from maintenance dredging on suspended particulate matter concentration in the Belgian nearshore area (southern North Sea),Mar. Pollut. Bull., 62(2), 258-269.
[https://doi.org/10.1016/j.marpolbul.2010.11.002]

-
Gardner, M.B., 1981, Effects of turbidity on feeding rates and selectivity of bluegills, Trans. Am. Fish. Soc., 110, 446-450.
[https://doi.org/10.1577/1548-8659(1981)110<446:EOTOFR>2.0.CO;2]

-
Goldes, S.A., Ferguson, H.W., Moccia, R.D. and Daoust, P.Y., 1988, Histological effects of the inert suspended clay kaolin on the gills of juvenile rainbow trout, Salmo gairdneri Richardson, J. Fish Dis., 11(1), 23-33.
[https://doi.org/10.1111/j.1365-2761.1988.tb00520.x]

- Gordon, A.K., Niedballa, J. and Palmer, G.C., 2013, Sediment as a physical water quality stressor on macro-invertebrates: A contribution to the development of a water quality guideline for suspended solids, Water Research Commission.
-
Gordon, A.K. and Palmer, C.G., 2015, Defining an exposure–response relationship for suspended kaolin clay particulates and aquatic organisms: Work toward defining a water quality guideline for suspended solids, Environ. Toxicol. Chem., 34(4), 907-912.
[https://doi.org/10.1002/etc.2872]

-
Grant, J. and Thorpe, B., 1991, Effects of suspended sediment on growth, respiration, and excretion of the soft-shell clam (Mya arenaria), Can. J. Fish. Aquat. Sci., 48(7), 1285-1292.
[https://doi.org/10.1139/f91-154]

-
Griffin, F.J., Smith, E.H., Vines, C.A. and Cherr, G.N., 2009, Impacts of Suspended Sediments on Fertilization, Embryonic Development, and Early Larval Life Stages of the Pacific Herring, Clupea pallasi, Biol. Bull., 216(2), 175-187.
[https://doi.org/10.1086/BBLv216n2p175]

-
Harrod, T.R. and Theurer, F.D., 2002, Sediment, In: Haygarth, P.M., Jarvis, S.C. (Eds.), Agriculture, hydrology and water quality, CABI, Wallingford, p. 502.
[https://doi.org/10.1079/9780851995458.0155]

-
Hart, R.C., 1992, Experimental studies of food and suspended sediment effects on growth and reproduction of six planktonic cladocerans, J. Plank. Res., 14(10), 1425-1448.
[https://doi.org/10.1093/plankt/14.10.1425]

-
Hasenbein, M., Komoroske, L.M., Connon, R.E., Geist, J. and Fangue, N.A., 2013, Turbidity and salinity affect feeding performance and physiological stress in the endangered delta smelt, Integr. Comp. Biol., 53(4), 620-634.
[https://doi.org/10.1093/icb/ict082]

-
Haygarth, P.M., Bilotta, G.S., Bol, R., Brazier, R., Butler, P.J., Freer, J., Gimbert, L.J., Granger, S.J., Krueger, T., Naden, P., Old, G., Quinton, J.N., Smith, B. and Worsfold, P.J., 2006, Processes affecting transfer of sediment and colloids, with associated phosphorus, from intensively farmed grasslands: an overview of key issues, Hydrol. Process., 20, 4407-4413.
[https://doi.org/10.1002/hyp.6598]

- Herbert, D.W., Alabaster, J.S., Dart, M.C. and Lloyd, R., 1961, The effect of china-clay wastes on trout streams, Int. J. Air Water Pollut., 5(1), 56-74.
-
Hewitt, J.E. and Norkko, J., 2007, Incorporating temporal variability of stressors into studies: An example using suspension-feeding bivalves and elevated suspended sediment concentrations, J. Exp. Mar. Biol. Ecol., 341, 131-141.
[https://doi.org/10.1016/j.jembe.2006.09.021]

-
Holmes, T.H. and McCormick, M.I., 2010, Size-selectivity of predatory reef fish on juvenile prey, Mar. Ecol. Prog. Ser., 399, 273-283.
[https://doi.org/10.3354/meps08337]

-
Horkel, J.D. and Pearson, W.D., 1976, Effects of turbidity on ventilation rates and oxygen consumption of green sunfish, Lepomis cyanellus, Trans. Am. Fish. Soc., 105, 107-113.
[https://doi.org/10.1577/1548-8659(1976)105<107:EOTOVR>2.0.CO;2]

-
Hornbach, D.J., Way, C.M., Wissing, T.E. and Burky, A.J., 1984, Effects of particle concentration and season on the filtration rates of the freshwater clam, Sphaerium striatinum Lamarck (Bivalvia: Pisidiidae), Hydrobiol., 108, 83-96.
[https://doi.org/10.1007/BF02391636]

- Huntington, K.M. and Miller. D.C., 1989, Effects of suspended sediment, hypoxia, and hyperoxia on larval Mercenaria mercenaria (Linnaeus, 1758), J. Shellfish Res., 8, 37-42.
-
Isono, R.S., Kita J. and Setoguma, T., 1998, Acute effects of kaolinite suspension on eggs and larvae of some marine teleosts, Comp. Biochem. Physiol. Part C Toxicol. Pharmcol., 120, 449-455.
[https://doi.org/10.1016/S0742-8413(98)10022-1]

-
Iwata, N., Yokayanma, S., Tanaka, K., Kawana K. and Namba, K. 2011, Eco-physiological effects of suspended solids on fish-lethal effects of clay mineral suspension on Japanese flounder Paralichthys olivaceus in relation to the mineral composition and suspending method of clay mineral products, Nippon Suisan Gakkaishi, 77, 215-222.
[https://doi.org/10.2331/suisan.77.215]

-
Jobling, M., 1982, A study of some factors affecting rates of oxygen consumption of plaice, Pleuronectes platessa L, J. Fish Biol., 20(5), 501-516.
[https://doi.org/10.1111/j.1095-8649.1982.tb03951.x]

- Jones, T.C., Hunt, R.D. and King, N.W., 1997, Mammary Gland Veterinary Pathology.
- Kang, Y.-S., 1996, Redescription of Paracalanus parvus and P. indicus (Copepoda: Paracalanidae) recorded in the Korean waters, J. Kor. Fish. Soc., 29(3), 409-413.
-
Kang, H.K., 2012, Effects of suspended sediments on reproductive responses of Paracalanus sp. (Copepoda: Calanoida) in the laboratory, J. Plank. Res., 34(7), 626-635.
[https://doi.org/10.1093/plankt/fbs033]

-
Kathyayani, S.A., Muralidhar, M., Kumar, T.S. and Alavandi, S.V., 2019, Stress quantification in Penaeus vannamei exposed to varying levels of turbidity, J. Coast. Res., 86, 177-183.
[https://doi.org/10.2112/SI86-027.1]

- Kim, I., Lee, B., Choi, J. and Han, D., 2007, Measures for soil management to protect the aquatic ecosystem, Korea Meteorological Instritute (KMI), 1-185.
-
Kiørboe, T., Frantsen, E., Jensen, C. and Sørensen, G., 1981, Effects of suspended sediment on development and hatching of herring (Clupea harengus) eggs, Estuar. Coast. Shelf., 13(1), 107-111.
[https://doi.org/10.1016/S0302-3524(81)80109-0]

-
Kirk, K.L., 1992, Effects of suspended clay on Daphnia body growth and fitness, Fresh. Biol., 28(1), 103-109.
[https://doi.org/10.1111/j.1365-2427.1992.tb00566.x]

-
Kronvang, B., Laubel, A., Larsen, S.E. and Friberg, N., 2003, Pesticides and heavy metals in Danish streambed sediment, Hydrobiologia, 494(1-3), 93-101.
[https://doi.org/10.1023/A:1025441610434]

-
Lake, R.G., and Hinch, S.G., 1999, Acute effects of suspended sediment angularity on juvenille Coho salmon, Can. J. Fish. Aquat. Sci., 56(5), 862-867.
[https://doi.org/10.1139/f99-024]

- Lee, J.Y., 1994, Effect of silt and clay on the rates of respiration filtration and nitrogen excretion in shellfish Mactra veneriformis, Bull. Korean Fish. Soc., 27(1), 59-68.
- Lee, S.M., Park, G.S., Yoon, S.J., Kang, Y.S. and Oh, J.H., 2008, Development of ecotoxicological standard methods using early life stage of marine rotifer Brachionus plicatilis and bethic copepod Tigriopus japonicus, J. Kor. Soc. Ocean., 13(2), 129-139.
-
Lee, J., Hong, S., Kim, T., Lee, C., An, S.A., Kwon, B.O., Lee, S., Moon, H.-B., Giesy, J.P. and Khim, J.S., 2020, Multiple bioassays and targeted and nontargeted analyses to characterize potential toxicological effects associated with sediments of masan bay: Focusing on AhR-mediated potency, Environ. Sci. Technol., 54(7), 4443-4454.
[https://doi.org/10.1021/acs.est.9b07390]

-
Lefevre, S., Bayley, M. and Mckenzie, D., 2015, Measuring oxygen uptake in fishes with bimodal respiration, J. Fish. Bio., 88, 206-231.
[https://doi.org/10.1111/jfb.12698]

-
Lloyd, D.S., Koenings, J.P. and Laperriere, J.D., 1987, Effects of turbidity in fresh waters of Alaska, N. Am. J. Fish. Manag., 7(1), 18-33.
[https://doi.org/10.1577/1548-8659(1987)7<18:EOTIFW>2.0.CO;2]

-
Li, Y. and Shen, A.L., 2012, Gill Damage and Recovery in Juvenile Black Sea Bream Acanthopagrus schlegelii Stressed by Uncontaminated Suspended Solids, Adv. Mater. Res. 518, 5047-5054.
[https://doi.org/10.4028/www.scientific.net/AMR.518-523.5047]

-
Lin, H.P., Charmantier, G., Thuet, P. and Trilles, J.P., 1992, Effects of turbidity on survival, osmoregulation and gill Na+-K+ ATPase in juvenile shrimp Penaeus japonicas, Mar. Ecol. Prog. Ser., 90, 31-37.
[https://doi.org/10.3354/meps090031]

-
Liu, Y., Junaid, M., Xu, P., Zhong, W., Pan, B. and Xu, N., 2020, Suspended sediment exacerbates perfluorooctane sulfonate mediated toxicity through reactive oxygen species generation in freshwater clam Corbicula fluminea, Environ. Pollut., 267, 115671.
[https://doi.org/10.1016/j.envpol.2020.115671]

-
MacDonald, B.A., Bacon, G.S. and Ward, J.E., 1998, Physiological responses of infaunal (Mya arenaria) and epifaunal (Placopecten magellanicus) bivalves to variations in the concentration and quality of suspended particles II. Absorption efficiency and scope for growth, J. Exp. Mar. Biol. Ecol., 219, 127-141.
[https://doi.org/10.1016/S0022-0981(97)00178-0]

-
McFarland, V.A. and Peddicord, R.K., 1980, Lethality of a suspended clay to a diverse selection of marine and estuarine macrofauna, ARCH Environ. Contam. Toxicol., 9(6), 733-741
[https://doi.org/10.1007/BF01055548]

-
Michel, C., Schmidt-Posthaus, H. and Burkhardt-Holm, P., 2013, Suspended sediment pulse effects in rainbow trout (Oncorhynchus mykiss)—relating apical and systemic responses, Can. J. Fish. Aquat. Sci., 70(4), 630-641.
[https://doi.org/10.1139/cjfas-2012-0376]

-
Miller, J.R., 1997, The role of fluvial geomorphic processes in the dispersal of heavy metals from mine wastes, J. Geochem. Explorat., 58, 101-118.
[https://doi.org/10.1016/S0375-6742(96)00073-8]

- MOF (Ministry of Oceans and Fisheries), 1999, Capital area port function establishment and reorganization plan (Vol. 7: Environmental impact survey).
- MOF (Ministry of Oceans and Fisheries), 2021, Development of Advanced Science and Technology for Marine Environmental Impact Assessment.
- Moore, P.G., 1978, Inorganic particulate suspensions in the sea and their effects on marine animals, Oceanogr. Mar. Biol., 15, 225-363.
- Morgan, R.P.I., Rasin, V.J. and Copp, R., 1973, Effects of suspended sediments on the development of eggs and larvae of striped bass and white perch, Final Report to U.S. Army Corps of Engineers, Philadelphia.
-
Morgan, R.P.I., Rasin, V.J. and Noe, L.A., 1983, Sediment effects on eggs and larvae of striped bass and white perch, Trans. Am. Fish. Soc., 112, 220-224.
[https://doi.org/10.1577/1548-8659(1983)112<220:SEOEAL>2.0.CO;2]

-
Murphy, R.C., 1985, Factors affecting the distribution of the introduced bivalve, Mercenaria mercenaria, in a California lagoon: The importance of bioturbation, J. Mar. Res., 43, 673-692.
[https://doi.org/10.1357/002224085788440312]

-
Neumann, D.A., O’Connor, J.M., Sherk, J.A. and Wood, K.V., 1975, Respiratory and hematological responses of oyster toadfish (Opsanus tau) to suspended solids, T. Am. Fish. Soc., 104(4), 775-781.
[https://doi.org/10.1577/1548-8659(1975)104<775:RAHROO>2.0.CO;2]

-
Neumann, D.A., O’Connor, J.M., Sherk, J.A. and Wood, K.V., 1982, Respiratory response of striped bass (Morone saxatilis) to suspended solids, Estuaries, 5, 28-39.
[https://doi.org/10.2307/1352214]

-
Newcombe, C. and Macdonald, D., 1991, Effects of suspended sediments on aquatic ecosystems, N. Am. J. Fish. Manage., 11, 72-82.
[https://doi.org/10.1577/1548-8675(1991)011<0072:EOSSOA>2.3.CO;2]

-
Newcombe, C.P. and Jensen, J.O., 1996, Channel suspended sediment and fisheries: a synthesis for quantitative assessment of risk and impact, N. Am. J. Fish. Manag., 16(4), 693-727.
[https://doi.org/10.1577/1548-8675(1996)016<0693:CSSAFA>2.3.CO;2]

-
Nichols, M., Diaz, R.J. and Schaffner, L.C., 1990, Effects of hopper dredging and sediment dispersion, Chesapeake Bay, Environ. Geol. Water Sci., 15(1), 31-43.
[https://doi.org/10.1007/BF01704879]

- Nimmo, D. R., Hamaker, T. L., Matthews, E. and Young. W.T., 1982, The long-term effects of suspended particulates on survival and reproduction of the mysid shrimp, Mysidopsis bahia, in the laboratory. Ecological stress and the New York Bight. Estuarine Research Federation, Columbia, South Carolina. 413-422.
- Noggle, C.C., 1978, Behavioral, physiological and lethal effects of suspended sediment on juvenile salmonids, M.S. thesis, Washington Univ., Seattle, WA, USA.
-
Norkko, J., Hewitt, J.E. and Thrush, S.F., 2006, Effects of increased sedimentation on the physiology of two estuarine soft-sediment bivalves, Austrovenus stutchburyi and Paphies australis, J. Exp. Mar. Biol. Ecol., 333, 12-26.
[https://doi.org/10.1016/j.jembe.2005.11.015]

-
Nuttall, P.M. and Bielby, G.H., 1973, The effect of china-clay wastes on stream invertebrates, Environ. Pollut., 5(2), 77-86.
[https://doi.org/10.1016/0013-9327(73)90013-X]

-
Ohata, R., Masuda, R., Ueno, M., Fukunishi, Y. and Yamashita, Y., 2011, Effects of turbidity on survival of larval ayu and red sea bream exposed to predation by jack mackerel and moon jellyfish, Fish. Sci., 77(2), 207-215.
[https://doi.org/10.1007/s12562-010-0320-9]

-
Ohata, R., Masuda, R., Takahashi, K. and Yamashita, Y., 2014, Moderate turbidity enhances schooling behaviour in fish larvae in coastal waters, Ices. J. Mar. Sci., 71(4), 925-929.
[https://doi.org/10.1093/icesjms/fss194]

- Park, C.B., Na, S. O., Lee, C.H., Kim, B.H., Lee, Y.D., Moon, S.H., Lee, J.J., Chung, S.C., Lee, K.W., Rho, S., Song, C.B., Choi, K.S., Lee, J.H., Yeo, I.K. and Jeon, Y.J., 2002, Effects of formalin on the development of fertilized eggs and hatched larvae in olive flounder, Paralichthys olivaceus, Kor. J. Envion. Toxicol., 17(2), 13-19.
- Peddicord, R.K., McFarland, V.A., Belfiori, D.P. and Byrd, T.E., 1975, Effects of suspended solids on San Francisco Bay organisms. Physical impact study, appendix G, dredged disposal study, San Francisco Bay and Estuary, San Francisco District, US Army Corps of Engineers, San Francisco, July, 158.
- Peddicord, R. and McFarland. V., 1976, Effects of suspended dredged material on the commercial crab, Cancer magister, Proceedings of the specialty conference on dredging and its environmental effects, ASCE, Mobile, Alabama. 633-644.
- Peddicord, R.K., 1980, Direct effects of suspended sediments on aquatic organisms. Contaminants and sediments. Volume 1. Fate and transport, case studies, modeling, toxicity, Ann Arbor Science Publishers, Ann Arbor, Michigan. 501-536.
-
Quinn, J.M., Davies-Colley, R.J., Hickey, C.W., Vickers, M.L. and Ryan, P.A., 1992, Effects of clay discharges on streams, Hydrobiologia, 248(3), 235-247.
[https://doi.org/10.1007/BF00006150]

- Reis, P.A., 1969, Effects of inorganic limestone sediment and suspension on the eggs and fry of Branchydanio rerio, M.S. thesis, DePauw Univ., Greencastle, Indiana.
-
Reynolds, J.B., Simmons, R.C. and Burkholder, A.R., 1989, Effects of placer mining discharge on health and food of Arctic grayling, J. Am.Water Resour. Assoc., 25(3), 625-635.
[https://doi.org/10.1111/j.1752-1688.1989.tb03100.x]

- Robertson, M., 1957, The effects of suspended materials on the reproductive rate of Daphnia magna, Publ. Inst. Mar. Sci. Univ. Tex., 4, 265-277.
-
Robertson, M.J., Scruton, D.A. and Clarke, K.D., 2007, Seasonal effects of suspended sediment on the behaviour of juvenile Atlantic salmon, Trans. Am. Fish. Soc., 136(3), 822-828.
[https://doi.org/10.1577/T06-164.1]

-
Robinson, S.E., Capper, N.A. and Klaine, S.J., 2010, The effects of continuous and pulsed exposures of suspended clay on the survival, growth, and reproduction of Daphnia magna, Environ. Toxicol. Chem., 29(1), 168-175.
[https://doi.org/10.1002/etc.4]

-
Robinson, W.E., Wehling, W.E. and Morse, M.P., 1984, The effect of suspended clay on feeding and digestive efficiency of the surf clam Spisula solidissima (Dillwyn), J. Exp. Mar. Biol. Ecol., 74, 1-12.
[https://doi.org/10.1016/0022-0981(84)90034-0]

-
Rosenberg, D.M. and Wiens, A.P., 1978, Effects of sedimentation on macrobenthic invertebrates on a northern Canadian river, Water Res., 12, 753-763.
[https://doi.org/10.1016/0043-1354(78)90024-6]

- Rogers, B. A. 1969, Tolerance levels of four species of estuarine fishes to suspended mineral solids, M.S. thesis, Rhode Island Univ., Kingston.
-
Ross, L.G., Ward, K.M.H. and Ross, B., 1985, The effects of formalin, malachite green and suspended solids on the respiratory activity of rainbow trout, Salmo gairdneri Richardson, Aquac. Res., 16(2), 129-138.
[https://doi.org/10.1111/j.1365-2109.1985.tb00302.x]

-
Russell, M.A., Walling, D.E., Webb, B.W. and Bearne, R., 1998, The composition of nutrient fluxes from contrasting UK river basins, Hydrol. Process., 12, 1461-1482.
[https://doi.org/10.1002/(SICI)1099-1085(199807)12:9<1461::AID-HYP650>3.0.CO;2-6]

- Schubel, J. R., and Wang, J., 1973, The effects of suspended sediment on the hatching success of Perca flavescens (yellow perch), Morone americana (white perch), Morone saxatilis (striped bass), and Alosa pseudoharengus (alewife) eggs, Johns Hopkins University.
-
Seo, J.Y., Ha, H.K., Im, J., Hwang, J.H., Choi, S.M., Won, N.I. and Kim, Y., 2018, Impact of seasonal vertical stratification on the dispersion patterns of dredging plumes off the south coast of Korea,Mar. Geol., 395, 14-21.
[https://doi.org/10.1016/j.margeo.2017.09.005]

-
Shaw, E.A. and Richardson, J.S., 2001, Direct and indirect effects of sediment pulse duration on stream invertebrate assemblages and rainbow trout (Oncorhynchus mykiss) growth and survival, Can. J. Fish. Aquat. Sci., 58(11), 2213-2221.
[https://doi.org/10.1139/f01-160]

-
Shen, A. and Li, Y., 2012, Gill damage and recovery in juvenile Black Sea bream Acanthopagrus schlegelii stressed by uncontaminated suspended solids, Adv. Mat. Res., 518-523.
[https://doi.org/10.4028/www.scientific.net/AMR.518-523.5047]

- Sherk, J.A., O’Connor, J.M., Neumann, D.A., Prince, R.D. and Wood, K.V., 1974, Effects of suspended and deposited sediments on estuarine organisms, Phase II. University of Maryland Natural Resources Institute, 74-20.
- Shin, M.J., Lee, C., Lee, J.E. and Seo, E.W., 2006, Effect of turbidity changes on antioxidant enzyme activity of Carassius auratus tissues, Korean J. Environ. Biol., 24(2), 119-125.
-
Sigler, J.W., Bjornn, T.C. and Everest, F.H., 1984, Effects of chronic turbidity on density and growth of steelheads and coho salmon, Trans. Am. Fish. Soc., 113, 142-150.
[https://doi.org/10.1577/1548-8659(1984)113<142:EOCTOD>2.0.CO;2]

-
Sirois, P. and Dodson, J.J., 2000, Influence of turbidity, food density and parasites on the ingestion and growth of larval rainbow smelt Osmerus mordax in an estuarine turbidity maximum, Mar. Ecol. Prog. Ser., 193, 167-179.
[https://doi.org/10.3354/meps193167]

-
Skykora, J. L., Smith, E. J. and Skynak, M., 1972, Effect of lime neutralized iron hydroxide suspensions on juvenile brook trout (Salvelinus fontinalis, Mitchill), Water Res. Pergamon Press, 6, 935-950.
[https://doi.org/10.1016/0043-1354(72)90045-0]

- Slaney, P.A., Halsey, T.G. and Tautz, A.F., 1977, Effects of forest harvesting practices on spawning habitat of stream salmonids in the Centennial Creek watershed, British Columbia.
-
Steger, K.K. and Gardner, J.P.A., 2007, Laboratory experiments on the effects of variable suspended sediment concentrations on the ecophysiology of the porcelain crab Petrolisthes elongatus (Milne Edwards, 1837), J. Exp. Mar. Biol. Ecol., 344, 181-192.
[https://doi.org/10.1016/j.jembe.2007.01.004]

- Stober, Q.J., Ross, B.D., Melby, C.L., Dinnel, P.A., Jagielo, T.H. and Salo, E.O., 1981, Effects of suspended volcanic sediment on Coho and Chinook Salmon in the Toutle and Cowlitz rivers, 1-147.
-
Suedel, B.C., Lutz, C.H., Clarke, J.U. and Clarke, D.G., 2012, The effects of suspended sediment on walleye (Sander vitreus) eggs, J. Soils Sediments, 12(6), 995-1003.
[https://doi.org/10.1007/s11368-012-0521-1]

-
Suedel, B.C., Wilkens, J.L. and Kennedy, A.J., 2017, Effects of suspended sediment on early life stages of smallmouth bass (Micropterus dolomieu), Arch. Environ. Contam. Toxicol., 72(1), 119-131.
[https://doi.org/10.1007/s00244-016-0322-4]

-
Summers, R.B., Thorp, Alexander, J.E. and Fell, R.D., 1996, Respiratory adjustment of dreissenid mussels (Dreissena polymorpha and Dreissena bugensis) in response to chronic turbidity, Can. J. Fish. Aquat. Sci., 53, 1626-1631.
[https://doi.org/10.1139/f96-096]

-
Sutherland, A.B. and Meyer, J.L., 2007, Effects of increased suspended sediment on growth rate and gill condition of two southern Appalachian minnows, Environ. Biol. Fish., 80(4), 389-403.
[https://doi.org/10.1007/s10641-006-9139-8]

-
Tse, C.Y., Chan, K.M. and Wong, C.K., 2010, DNA damage as a biomarker for assessing the effects of suspended solids on the orange-spotted grouper, Epinephelus coioides, Fish Physiol. Biochem., 36(2), 141-146.
[https://doi.org/10.1007/s10695-008-9243-0]

-
Turner, E.J. and Miller, D.C., 1991, Behavior and growth of Mercenaria mercenaria during simulated storm events, Mar. Biol., 111, 55-64.
[https://doi.org/10.1007/BF01986346]

- US EPA, 2007, www.epa.gov/waterscience/criteria/wqcriteria.
-
Utne-Palm, A.C., 2004, Effects of larvae ontogeny, turbidity, and turbulence on prey attack rate and swimming activity of Atlantic herring larvae, J. Exp. Mar. Biol Ecol., 310(2), 147-161.
[https://doi.org/10.1016/j.jembe.2004.04.005]

-
Van Nieuwenhuyse, E.E. and LaPerriere, J.D., 1986, Effects of placer gold mining on primary production in subarctic streams of Alaska, J. Am. Water. Resour. Assoc., 22(1), 91-99.
[https://doi.org/10.1111/j.1752-1688.1986.tb01864.x]

-
Wagener, S.M. and LaPerriere, J.D., 1985, Effects of placer mining on the invertebrate communities of interior Alaska streams, Freshw. Invertebr. Biol., 4(4), 208-214.
[https://doi.org/10.2307/1467163]

-
Wakeman, T., Sustar, J. and Peddicord, R., 1975, Effects of suspended solids associated with dredging operations on estuarine organisms, IEEE OCEAN, 75, 431-436.
[https://doi.org/10.1109/OCEANS.1975.1154044]

- Wallen, I.E., 1951, The direct effect of turbidity on fishes, Bull. Okla. Agric. Mech. Coll., 48, 1-27.
- Waters, T.F., 1995, Sediment in streams: sources, biological effects, and control, Bethesda, MA.
-
Wenger, A.S., Johansen, J.L. and Jones, G.P., 2012, Increasing suspended sediment reduces foraging, growth and condition of a planktivorous damselfish, J. Exp. Mar. Biol. Ecol., 428, 43-48.
[https://doi.org/10.1016/j.jembe.2012.06.004]

-
Wilber, D. and Clark D., 2001, Biological effects of suspended sediments: A review of suspended sediment impacts on fish and shellfish with relation to dredging activities in estuaries, N. Am. J. Fish. Manag., 21, 855-875.
[https://doi.org/10.1577/1548-8675(2001)021<0855:BEOSSA>2.0.CO;2]

-
Wilkens, J., Katzenmeyer, A., Hahn, N., Hoover, J. and Suedel, B., 2015, Laboratory test of suspended sediment effects on short-term survival and swimming performance of juvenile atlantic sturgeon (Acipenser oxyrinchus oxyrinchus, Mitchill, 1815). J. Appl. Ichthyol., 31, 984-990.
[https://doi.org/10.1111/jai.12875]

-
Yoon, S.J. and Park, G.S., 2011, Ecotoxicological effects of the increased suspended solids on marine benthic organisms, J. Environ. Sci., 20(11), 1383-1394.
[https://doi.org/10.5322/JES.2011.20.11.1383]

- Yurimoto, T., Tanaka, K., Nasu, H. and Matsuoka, K., 2008, Influence of resuspended sediments and their surface accumulation on a pen shell Atrina pectinata in Ariake Bay, west Japan, Aquac. Sci., 56(3), 335-342.
-
Zheng, L., Pan, L., Lin, P., Miao, J., Wang, X., Lin, Y. and Wu, J., 2017, Evaluating the toxic effects of three priority hazardous and noxious substances (HNS) to rotifer Brachionus plicatilis, Environ. Sci. Pollut. Res., 24(35), 27277-27287.
[https://doi.org/10.1007/s11356-017-0298-2]