해수중의 총이산화탄소와 총알칼리도 분석을 위한 탄산염 화학 이론 및 측정방법
초록
본 연구에서 새롭게 도출된 총알칼리도(AlkT)와 총이산화탄소(TCO2) 분석방법의 정밀도와 정확도를 확인하기 위해 스크립스 해양 연구소에서 제조된 이산화탄소 표준물질(Batch 132; AlkT=2229.24±0.39 μmol/kg, TCO2=2032.65±0.45μmol/kg)을 분석하였다. 분석 결과, 총알칼리도와 총이산화탄소의 평균 농도는 각각 2354.09 μmol/kg과 2089.60 μmol/kg으로 제시된 농도 값과 총알칼리도는 약 5.6%, 총이산화탄소는 약 2.3%의 차이를 보였다. 기존의 알칼리도 측정방법(Gran Titration)과 본 연구 분석 방법을 중탄산나트륨(NaHCO3) 0.340 g(AlkT 2023.33 μmol/kg) 용액에 적용하여 비교 실험을 진행한 결과, 기존의 방법으로 측정된 중탄산나트륨의 평균 알칼리도 농도는 2193.39 μmol/kg(sd=57.15, n=7)이었고, 본 연구방법의 경우 2017.02 μmol/kg(sd=10.98, n=7)의 알칼리도 평균 농도를 보였다. 또한, 초순수와 해수에 중탄산 나트륨을 첨가해 총알칼리도의 수득률(recovery yield)을 측정한 실험에서 초순수에 대한 첨가실험은 다양한 농도 변화 범위(0~4952.39 μmol/kg) 내에서 평균 약 100.8%(R2=0.999), 해수에 대한 첨가실험은 다양한 농도 변화 범위(0~2041.32μmol/kg)내에서 평균 약 102.3%(R2=0.999)로 나타났다. 해수의 이산화탄소 분압(pCO2)을 측정하는 Pro Oceanus사의 PSI-ProTM을 사용하여 측정된 이산화탄소 분압과 본 연구를 통해 측정된 H2CO3* 농도와의 비교 실험을 시행한 결과, 약 2주간의 경시변화 실험을 통하여 측정된 이산화탄소 분압은 427~705 μatm의 변화를 보였고, 본 연구방법으로 측정된 H2CO3*의 농도는 9.15~15.24 μmol/kg의 변화를 보였다. 측정된 분압과 계산된 H2CO3* 농도의 결정계수(R2)는 0.977로 나타났다. 본 연구방법을 적용해 동해 강릉 사천항의 표층 해수 중의 총알칼리도와 총이산화탄소의 일 변화 측정실험 결과, 두 항목의 농도는 일몰 이후 증가하고 일출 이후부터는 감소하는 경향을 보였다. 총이산화탄소와 용존산소의 농도는 상반되는 경향을 나타냈는데 이는 식물플랑크톤의 광합성과 호흡의 영향으로 생각된다. 현장 선상에서 시행된 북동태평양의 클라리온-클리퍼톤 균열대(Clarion-Clipperton Fracture Zone)에서 총알칼리도와 총이산화탄소의 측정실험 결과, 표층(0~60 m)과 저층(200~2000 m)에서 총알칼리도의 평균 농도는 각각 2422.38 μmol/kg(sd=78.73, n=20)과 2465.87 μmol/kg(sd=57.68, n=103)로 측정되었고, 표층과 저층저층의 총이산화탄소 평균 농도는 각각 2134.47 μmol/kg(sd=65.40, n=20)과 2431.87 μmol/kg(sd=65.02, n=103)으로 측정되었다. 총알칼리도와 총이산화탄소의 수직 분포는 수심이 증가할수록 점차 농도가 증가하는 경향을 확인할 수 있었으며, 측정된 농도 결과는 부근해역에서의 기존 연구 결과보다 약간 높은 경향을 보였다.
Abstract
To evaluate accuracy and precision of determination of total alkalinity (AlkT) and carbon dioxide (TCO2) derived from present study, experiment was applied with CO2 CRM (Batch 132, Scripps Institution of Oceanography; AlkT=2229.24±0.39 μmol/kg, TCO2=2032.65±0.45 μmol/kg). As the result, average concentration of AlkT and TCO2 was 2354.09 μmol/kg (~5.6% difference with CO2 CRM) and 2089.60 μmol/kg (~2.3% difference with CO2 CRM), respectively. For previous method (Gran Titration) by addition NaHCO3 to deionized water(AlkT 2023.33 μmol/kg), average concentration was 2193.39 μmol/kg (sd=57.15, n=7). Whereas, average concentration was 2017.02 μmol/kg (sd=10.98, n=7) for the present study. Recovery yield experiments of total alkalinity in deionized water and seawater were implemented by addition of NaHCO3. The recovery yield of deionized water in the range 0 to 4952.39 μmol/kg was 100.8% (R2=0.999), and seawater in the range 0 to 2041.32 μmol/kg was 102.3% (R2=0.999). Comparison of pCO2 sensor (PSI CO2-ProTM) with present method showed very meaningful correlation coefficient (R2=0.977) in the range of 427 to 705 μatm and 9.16 to 15.24 μmol/kg throught elapsed time for two weeks. Field experiment of diurnal variation of total carbon dioxide was accomplished at Sachon harbor in the coastal waters of East Sea of Korea. Concentration of AlkT and TCO2 was increased during night, and decreased during daylight hours. The results showed mirror type between TCO2 and dissolved oxygen, which was attributable to photosynthesis and respiration of phytoplankton. Also, open ocean field study was performed to obtain vertical profile of AlkT and TCO2 in C-C zone (Clarion-Clipperton Fracture Zone), Northeastern Pacific. Average concentrations of AlkT in the surface mixed layer (0~60 m) and deeper layer below 200 m were 2422.38 μmol/kg (sd=78.73, n=20) and 2465.87 μmol/kg (sd=57.68, n=103), respectively. And average concentrations of TCO2 were 2134.47 μmol/kg (sd=65.4, n=20) and 2431.87 μmol/kg (sd=65.02, n=103) in the same depth ranges such as AlkT. Vertical distributions of AlkT and TCO2 concentrations tended to increase with depth, and analyzed concentrations showed slightly higher than those of previous studies in this area.
Keywords:
Total alkalinity, Total carbon dioxide, Carbonate chemistry키워드:
총알칼리도, 총이산화탄소, 탄산염 화학1. 서 론
산업혁명 이후 화석연료 사용의 증가로 인해 대기 중의 이산화탄소농도는 점차 증가하여 약 400 ppm을 넘어섰다(Bala[2013]; Monastersky [2013]). 해양은 거대한 탄소 저장고로 증가하는 대기 중의 이산화탄소의 조절 인자로 중요하게 작용을 한다. 해양으로 유입된 이산화탄소는 해양산성화뿐만 아니라 해양의 화학조성비를 변화시켜 석회질로 구성된 생물들에게 영향을 미치고, 최근 정부간기후변화위원회(Intergovernmental Panel on Climate Change, IPCC)에서 제안된 이산화탄소 포집 및 저장(Carbon Capture & Storage, CCS) 기술의 진행으로 해양의 이산화탄소 측정이 중요해지고 있다(Riebesell[2000]; Riebesell et al.[2000]; Feely et al.[2004]; IPCC[2005]; Paquay[2013]).
해양에서 이산화탄소 계를 구성하고 있는 화학종(H2CO3*, HCO3-, CO32-)들은 직접적인 측정이 불가능 하기 때문에 측정 가능한 4개의 요소(dissolved inorganic carbon, total alkalinity, fugacity, pH)들 중 2개 이상의 자료를 사용해 측정한다. 이 중 해양의 알칼리도 측정방법은 과거부터 많은 과학자들에 의해 개발되어 왔으며, 대표적으로 역적정법(Back Titration Method, Pauss et al.[1990]), 전위차적정법(Potentiometric Titration, Anderson and Robinson[1946]; Gran[1952]), 광도적정법(Photometric Titration, Granéli and Anfält[1977]; Yao and Byrne[1998]) 등이 있다. 이러한 방법들은 정밀도가 0.1~0.2% 정도로 비교적 높지만 많은 시간이 소요되는 단점이 있다(Grasshoff et al.[1983]).
본 연구는 해수의 총알칼리도와 총이산화탄소를 비롯한 탄산염 화학종들의 농도를 측정하기 위해 새롭게 개선된 분석방법을 제시하여 신속하고 정확한 자료를 획득할 수 있도록 하고자 하였다.
2. 재료 및 방법
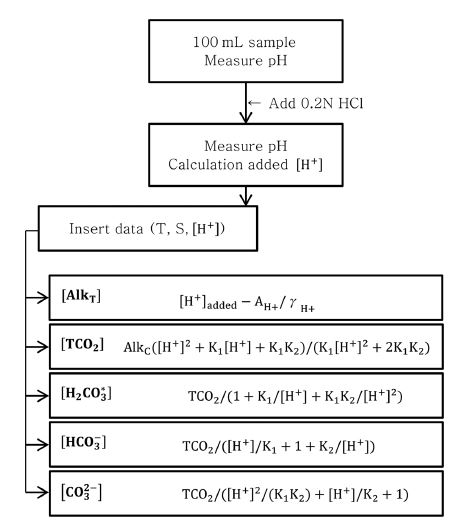
100 mL의 해수시료에 0.2N HCl(Merck)을 사용하여 약 pH 3.5 부근까지 산성화 시킨 후 초기 pH와 변화된 pH의 값을 탄산염 화학 이론에 적용하여 총알칼리도와 총이산화탄소를 비롯한 탄산염 화학종의 농도를 계산한다(Fig. 1). 계산과정에서 사용된 활동도 계수는 본 연구에서 독자적으로 구해진 관계식을 사용하였으며 본문 3.2에서 다루고자 한다. 전위차 적정법이나 pCO2 센서와 같은 기존실험 방법에 비하여 짧은 측정시간이 소요되기 때문에 대기 노출에 따른 영향은 무시할 수 있을 것으로 판단된다.
2.1 일반 측정 항목
수온과 염분, 용존산소의 농도는 Conductivity/Salinity meter(YSI-30)와 YSI 556 Multi-Probe system(YSI 556 MPS)을 사용하였다. 수소이온의 농도지수(pH)는 pH meter(Orion 3-star pH benchtop meter)와 pH 전극(Orion 8157BNUMD Ross Ultra Triode, range 0~14 pH, precision ±0.01)을 사용하였다. 표준물질 분석은 스크립스 해양 연구소에서 제조한 Batch132를 사용하였다. 또한, SIGMAALDRICH사의 중탄산나트륨(NaHCO3, Reagent Plus®≥99.5%)을 알칼리도 첨가 실험에 사용하여 수득률을 계산하였다. 이때 사용된 초순수는 질소기체를 사용하여 이산화탄소를 제거하였다. 해수의 이산화탄소 분압은 Pro Oceanus사의 PSI CO2-ProTM를 사용하여 측정하였다.
2.2 현장 연구
총이산화탄소의 일 변화 실험은 강원도 강릉시 사천 면에 위치한 사천 항에서 2012년 5월 11일 18:00부터 12일 17:00까지 1시간 간격으로 진행되었으며, 북동태평양 클라리온-클리퍼톤 균열대내에 위치한 우리나라 망간단괴 광구 해역에서 진행된 총알칼리도와 총이산화탄소의 수직 분포 측정실험은 2012년 9월 8일부터 21일까지 진행되었다. 총알칼리도와 총이산화탄소의 측정은 총 4개의 정점(131°W선상 12°N, 14°N, 16°N 그리고 16.5°N)에서 실시되었다. 광구 해역에서 진행된 실험에서는 로젯 멀티 샘플러(Rosette Multi-sampler)에 니스킨 채수기와 CTD system(Sea-Bird 911 Plus)을 부착하여 시료를 채취하였다. 채취한 시료는 생화학적 반응의 영향을 최소화 하기 위해 바로 선상 실험실로 옮겨 분석하였다.
3. 결과 및 토의
3.1 해수 탄산염 화학에 대한 이론적 고찰
해수의 총알칼리도(AlkT)는 식 (1)과 같이 정의되며(Dickson [1981]), 식 (2)에 의해 계산된다.
(1)
[AlkT] = [HCO3-] + 2[CO32-] + [B(OH)4-] + [OH-] - [H+]
(2)
[AlkT] = [H+ ]added- AH+/γH+
(AH+: 10-pH final, γH+: activity coefficient)
식 (2)에서 사용된 활동도 계수(γH+)는 본 연구를 통해 독자적으로 구해진 관계식을 사용하였으며, 그 관계식은 다음과 같다(modified from Davies[1962]).
(3)
logγH+= φzH+2 (I0.5/(1+I0.5) - ωI)
(φ = 1.824·106 (εK)-1.5, zH+= charge of H+)
(I: ionic strength, K: Kelvin temperature, ε: dielectric constant, φ and ω: experimental constant)
위 식에 사용된 이온세기 식은 다음의 식을 사용하였다.
(4)
I = 0.019924·S + 0.5(CH+) · VH+/Vs)
(S: salinity, CH+: concentration of added HCl, VH+: Volume of added HCl, Vs: Volume of sample)
또한, 탄산염 알칼리도(AlkC)는 식 (5)와 같이 표현되는데, 이를 식 (1)에 대입하면 식 (6)과 같은 형태로 탄산염 알칼리도를 구할 수 있다. 이때 필요한 붕산염([B(OH)4-])의 농도는 식 (7)~(11)의 과정을 통해 구하였다.
(5)
AlkC= [HCO3− ] + 2[CO32−]
(6)
AlkC= AlkT - [B(OH)4− ] - [OH−] + [H+]
(7)
[B(OH)3] = [B(OH)4−] + [H+]
(8)
KB= [B(OH)4− ][H+]/[B(OH)3]
(9)
BT= [B(OH)3] + [B(OH)4−]
(10)
BT= 1.18·10−5S
(11)
[B(OH)4−] =KBBT/(KB+ [H+])
한편, 해수중의 총이산화탄소(TCO2)의 농도는 다음의 식 (12)와 (13)으로 정의할 수 있다.
(12)
TCO2= [H2CO3*] + [HCO3−] + [CO32−]
(13)
TCO2= AlkC+ [H2CO3*] - [CO32−]
식 (13)에 필요한 탄산([H2CO3* ]), 탄산염([CO32−])의 농도를 구하기 위해 탄산염의 1차, 2차 해리식을 이용하였다.
(14)
[H2CO3* ] ↔[HCO3− ] + [H+]
(15)
[HCO3−] ↔[CO32−] + [H+]
(16)
K1= [HCO3− ][H+]/[H2CO3* ]
(17)
K2= [CO32−][H+]/[HCO3−]
(18)
[H2CO3* ] = TCO2/(1+K1/[H+]+K1K2/[H+]2)
(19)
[HCO3−] = TCO2/([H+]/K1+1+K2/[H+])
(20)
[CO32−] = TCO2/([H+]2/(K1K2)+[H+]/K2+1)
위의 과정을 통해 유도된 식 (18)~(20)은 탄산염 화학종들의 농도와 총이산화탄소 농도 사이의 관계식으로 식 (13)에 대입하여 총이산화탄소 농도 관계식을 유도할 수 있다.
(21)
TCO2= AlkC ([H+]2+K1[H+]+K1K2)/(K1[H+]2+2K1K2)
위의 식을 계산하는데 필요한 상수는 다음의 식을 사용하였다(Almgren et al.[1975]).
(22)
pKB= 1026/K + 5.527 - 1.58·10−2S + 1.6·10−4S2
(23)
pK1= 842/K+ 3.272 - 1.01·10−2S + 10−4S2
(24)
pK2= 1373/K + 4.854 - 1.935·10−2S + 1.35·10−4S2
3.2 수소이온(H+)의 활동도 계수(γH+)
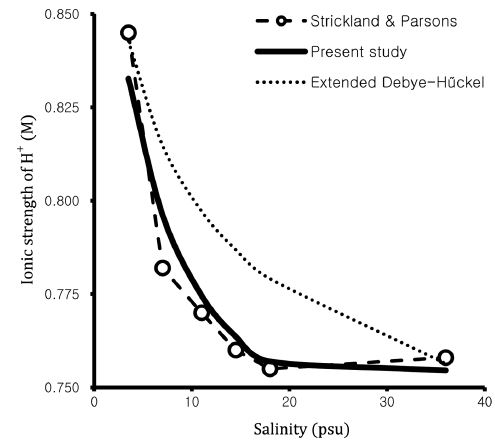
이온의 활동도 계수는 도출될 수 있는 많은 관계식이 존재한다(Stumm and Morgan[1995]). 하지만 해수의 이온세기에 맞는 활동도 계수 도출식은 찾기 어려운 실정이다. 본 연구에서는 이러한 문제점을 해결하기 위하여 독자적으로 구해진 관계식을 사용하였으며, 이 관계식의 정확성을 확인하기 위해 특정 염분에서 수소이온의 활동도 계수를 제시한 Strickland and Parsons의 값(Maita et al.[1984])과 비교하였다(Fig. 2). 그 결과 본 연구에서 도출한 관계식과 Stirckland and Parsons의 값 사이의 유사도는 99.8%를 보였다. 기존 해양 관련 연구에 자주 사용되었던 Extended Debye-Hűckel 식과 Strickland and Parsons의 값은 97.8%의 유사성을 보여 본 연구에서 도출된 수소이온의 활동도 계수 관계식이 좀더 높은 유사성을 보이는 것을 확인하였다. Extended Debye-Hűckel 식의 경우 염분 변화에 따른 수소이온의 활동도 계수를 제안하는데 한계가 있기 때문에 본 연구에서 도출된 관계식을 사용하면 보다 정확한 총알칼리도 및 총이산화탄소의 농도 계산이 가능할 것으로 생각된다.
3.3 CO2 Certified Reference Material(CRM) 측정
본 연구방법을 사용해 스크립스 해양 연구소에서 제조한 표준물질 Batch 132를 분석하였다. 스크립스 해양 연구소에서 제공한 CO2 CRM의 총알칼리도와 총이산화탄소의 농도는 각각 2229.24±0.39μmol/kg과 2032.65±0.45 μmol/kg이다. 본 연구방법을 통해 측정된 총알칼리도와 총이산화탄소의 평균 농도는 각각 2354.09 μmol/kg과 2089.60 μmol/kg의 결과 값을 보여 스크립스 해양 연구소에서 제시한 값과 본 연구방법으로 측정된 알칼리도 값은 5.6%, 이산화탄소는 2.3%의 차이를 보였다(Table 1).
3.4 Gran Titration 방법과의 비교
본 실험은 초순수(deionized water) 2 L에 중탄산나트륨(NaHCO3)0.340 g을 첨가하여 제조한 실험수에 Gran Titration과 본 연구방법을 각각 7회 반복하여 측정된 총알칼리도의 농도를 비교하였다(Table 2). Gran Titration을 통해 측정된 총알칼리도는 2069.40~2242.00 μmol/kg의 범위로 평균 2193.39 μmol/kg (sd=57.15)을 보였고, 본 연구방법을 통해 측정된 총알칼리도는 1999.53~2028.74 μmol/kg의 범위를 나타냈으며, 평균 2017.02 μmol/kg(sd=10.98)을 보였다. 중탄산나트륨을 첨가한 초순수의 이론적인 총알칼리도 농도(2023.33 μmol/kg)와 비교했을 때 Gran Titration은 165.30 μmol/kg, 본 연구방법은 6.31 μmol/kg의 차이를 보여 Gran Titration에 못지않은 실험 결과를 보였다. 또한, 기존의 측정방법들은 고가의 자동 적정 장치가 필요하고 측정시간이 20분에서 1시간 정도가 소요되는데 비하여 본 연구방법은 상대적으로 저가의 pH meter와 전극을 사용하여 5분 이내의 짧은 시간에 측정이 가능한 장점이 있다.
3.5 알칼리도 첨가 실험
본 연구방법의 수득률(recovery yield)를 구하기 위해 초순수와 해수에 중탄산나트륨을 첨가하여 각 농도 별로 3회씩 측정하였다. 시료에 첨가된 중탄산나트륨은 용해되어 H2CO3*, HCO3− 그리고 CO32− 등으로 재평형을 이루게 되고 이에 따라 총알칼리도와 총이산화탄소의 농도가 변화된다(식 (1)과 (12)). 초순수에 각기 다른 농도(0,257.62 그리고 4952.39 μmol/kg)의 중탄산나트륨을 첨가하여 실험한 결과, 총알칼리도와 총이산화탄소 농도는 Fig. 3과 Table 3에 나타난 바와 같다. 초순수에 대한 첨가 실험의 결과, 회귀직선 관계식에서 총알칼리도와 총이산화탄소 모두 기울기가 1에 근접하고 결정 계수(R2) 또한 0.999와 1.000로 나타나 매우 정밀하고 정확한 실험 결과를 보였다.
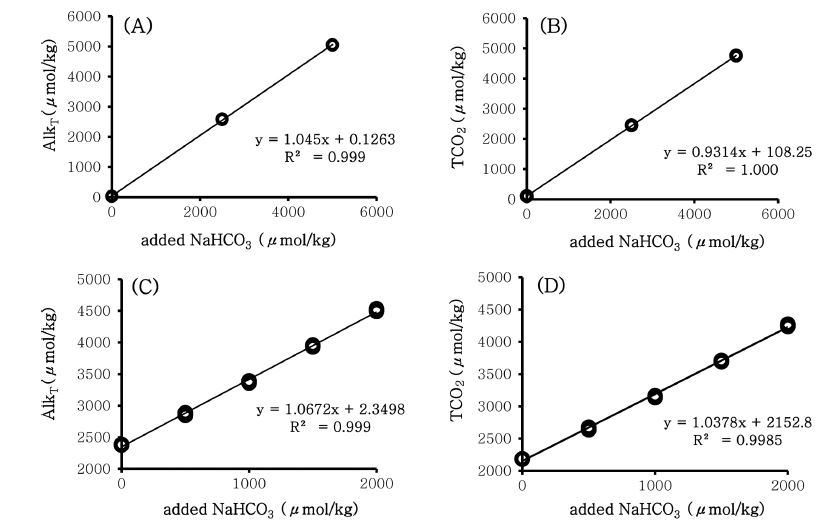
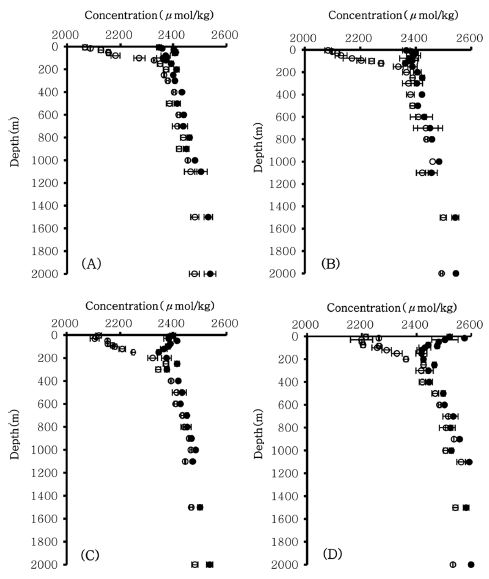
Result of NaHCO3 addition experiment of deionized water and seawater. (A) Total alkalinity of deionized water. (B) Total carbon dioxide of deionized water. (C) Total alkalinity of seawater. (D) Total carbon dioxide of seawater.
해수에 각기 다른 농도(0, 510.33, 1020.66, 1530.99 그리고 2041.32μmol/kg)의 중탄산나트륨을 첨가하여 실험한 결과 역시 초순수에서와 마찬가지로 총알칼리도와 총이산화탄소의 회귀직선 식에서 기울기가 1에 근접하고 결정계수(R2) 역시 0.999를 보여 본 연구방법이 해수의 경우에도 정밀하고 정확하게 적용되는 것을 확인할 수 있었다(Fig. 3, Table 3).
측정된 농도를 아래의 식 (25)를 통해 수득률을 계산한 결과 초순수와 해수의 평균 수득률은 각각 100.8±0.7%와 102.3±3.8%의 값을 보였다.
(25)
수득률(%) = (측정값 - Blank값) /이론값 · 100
본 연구방법에서 획득한 수득률은 100%를 약간 초과하는 값인데, 이는 실험과정에서 발생할 수 있는 일시적인 비 평형 때문으로 판단된다(Moosbrugger et al.[1993]).
3.6 pCO2 측정 장비와의 비교
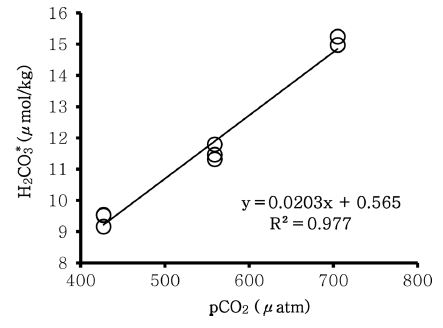
본 연구에 사용된 pCO2 센서(PSI CO2-ProTM)는 현장이나 실험실에서 mooring을 위해 개발된 기기로 적외선을 이용해 펌프로 공급된 해수의 이산화탄소 분압을 측정한다. pCO2 센서 측정값과 본 연구방법을 비교하기 위한 실험은 인천항 부근에서 채취한 해수를 넣은 수조를 실험실에 설치해 약 2주간 경시변화를 관측하였다. 실험기간 동안 pCO2 센서를 통해 측정된 이산화탄소 분압(427~705 μatm)과 본 연구를 통해 측정된 H2CO3*의 농도(9.16~15.24 μmol/kg)와의 상관관계는 Fig. 4와 같다. 회귀직선 식에 나타난 바와 같이, y절편이 0.565로 0에 근접하는 것을 확인하였고, 결정계수(R2) 또한 0.977로 매우 높은 상관관계를 보였다.
3.7 총이산화탄소 일변화 측정
본 연구방법을 현장에 적용해 동해 사천항 부근의 해역에서 24시간동안 매시간 총이산화탄소의 일변화를 조사하였다. 연구해역의 pH는 최소 7.938에서 최대 8.026 사이의 변화를 보였는데, 일몰(19:24) 이후에는 감소하고 일출(05:17) 이후에는 증가하는 경향을 나타냈다(Fig. 5A). 총알칼리도(2341.07~2530.02 μmol/kg)와 총이산화탄소(2216.37~2387.62 μmol/kg)의 농도는 pH와는 반대로 일몰 이후에는 증가하고 일출 이후에는 감소하는 경향을 보였다(Fig. 5B). 본 연구방법을 통해 측정된 총알칼리도와 총이산화탄소 농도를 용존 산소 농도와 비교한 결과 대체로 mirror type의 경향을 보였는데(Fig. 5B), 이는 식물플랑크톤의 광합성과 호흡에 의한 것으로 생각된다(Wurts[2002]; Orr et al.[2005]).
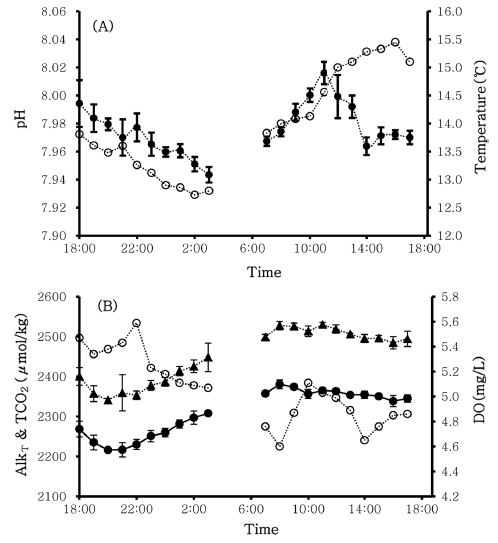
(A) Diurnal variation of pH and temperature in Sachon harbor, Gangneung in Korea (close circle: pH, open circle: temperature). (B) Comparison plot between total alkalinity (and total CO2) and dissolved oxygen in Sachon harbor, Gangneung in Korea (close triangle: total alkalinity, close circle: total carbon dioxide, open circle: dissolved oxygen).
3.8 북동태평양의 총알칼리도 및 이산화탄소 분포
본 연구방법을 북동태평양 클라리온-클리퍼톤 균열대 해역에 위치한 정점에 적용하여 총알칼리도와 총이산화탄소의 수직분포를 측정하였다. 수직분포 자료의 통계해석은 CTD에서 획득된 수층별 수온 자료를 참고하여 수심 60 m 이내의 표층혼합층(surface mixed layer)과 200 m 이하의 심층(deep layer)으로 구분하여 처리하였다. 측정 결과를 보면(Fig. 6), 표층혼합층의 총알칼리도 평균은 2422.38μmol/kg(sd=78.73, n=20)으로 측정되었고, 심층의 총알칼리도는 평균 2465.87 μmol/kg(sd=57.68, n=103)으로 측정되었다. Feely et al.[2002]에 의하면 북태평양의 총알칼리도는 2275~2425 μmol/kg 사이의 범위를 갖는 것으로 알려졌는데 본 연구에서 얻어진 총알칼리도는 2341.10~2602.56 μmol/kg의 범위를 보여 기존의 연구결과보다 약간 높은 결과를 보였다. 연구지역 표층혼합층의 총이산화탄소는 평균 2134.47 μmol/kg(sd=65.40, n=20)이었고, 심층의 총이산화탄소는 평균 2431.87 μmol/kg(sd=65.02, n=103)의 농도를 보였다. Feely et al.[2002]의 연구결과에서 북태평양의 총이산화탄소 농도는2050~2380 μmol/kg의 범위를 보였는데, 전 정점을 통해 파악된 총 이산화탄소 농도 역시 2060.92~2574.33 μmol/kg의 범위를 보여 약간 높은 결과 값을 보였다. 총알칼리도와 총이산화탄소의 결과가 기존의 연구결과보다 높은 농도를 보이는 이유는 조사 해역이 용승의 영향을 받는 해역이기 때문이라고 판단된다(Millero et al.[1998]). 연구해역의 총알칼리도와 총이산화탄소의 분포는 표층에서 저층으로 갈수록 증가하는 경향을 보였는데, 이는 표층혼합층보다 심층에서 CaCO3의 양이 풍부하고(Kanamori and Ikegami[1982]), 유기물의 분해에 따른 총이산화탄소의 증가에 의한 것으로 생각된다.
4. 결 론
본 연구에서는 총알칼리도와 총이산화탄소 측정 시 독자적으로 구한 활동도 계수 관계식을 사용한 측정방법을 제시하였고, 이 방법의 정밀도와 정확도를 확인하기 위해 여러 실험이 진행되었다. 먼저, 이산화탄소 표준물질(Batch 132; 스크립스 해양 연구소)을 분석한 결과 본 연구의 측정값이 약간 높게 측정되었다. 또한 중탄산나트륨에 기존의 알칼리도 측정방법(Gran Titration)과 본 연구분석 방법의 적용에서도 약간 높은 농도가 측정되었다. 초순수와 해수에 각각 중탄산나트륨을 첨가한 후 수득률(recovery yield)을 측정한 실험에서는 전반적으로 평균 수득률이 약 101.6%(R2=0.999)로 나타났다. 해수의 이산화탄소 분압(pCO2)을 측정하는 기기 결과치와 본 연구를 통해 측정된 H2CO3*농도와의 비교결과 두 농도의 상관관계(R2)는 높게 나타났다.
동해 강릉 사천항의 표층해수에서 이산화탄소의 일 변화 측정실험을 통해 일몰 이후 증가하고 일출 이후부터는 감소하는 경향을 확인하였으며, 총알칼리도와 총이산화탄소는 용존산소의 농도 분포와 서로 상반되는 경향을 나타냈다. 북동태평양의 클라리온-클리퍼톤 균열대에서 총알칼리도와 총이산화탄소의 농도를 분석한 결과 기존에 알려진 농도 범위보다 약간 높은 값을 보였는데, 이는 조사해역이 용승의 영향을 받는 곳이기 때문이며, 수직분포는 수심이 증가할수록 점차 증가하는 경향을 보였다.
위와 같이 기존의 관측 기기 및 분석 방법과의 비교검증과 현장검증의 결과 본 연구방법이 해수 중 총알칼리도와 총이산화탄소의 농도 및 분포를 잘 구현하였고, 표준물질 측정을 통해 총알칼리도는 절대값 5.6% 이내에서, 총이산화탄소는 절대값 2.3% 이내의 범위에서 신뢰성 있는 자료를 획득할 수 있는 것으로 확인되었다. 따라서 본 연구를 통해 제시한 방법은 기존의 측정방법보다 비용과 시간적인 측면에서 매우 효율적일 것으로 판단된다. 아울러 탄산염 화학종(H2CO3*, HCO3−,CO32−)들의 농도 역시 파악할 수 있기 때문에 탄산염화학과 관련된 연구에 있어 유용할 것이라 생각된다.
Acknowledgments
본 연구논문은 2013년 인하대학교 일반대학원 석사논문(해수중의 총이산화탄소 및 총알칼리도 분석을 위한 탄산염 화학 이론 및 측정방법)을 근거로 하고 있음을 밝힙니다.
본 연구는 (주)지오시스템리서치의 연구비 지원 하에 진행되었습니다(인하대학교 과제번호: 42585, 44591, 46365). 북동태평양 현장조사는 한국해양과학기술원(KIOST) 심해저광물자원연구센터의“태평양 심해저 광물자원 개발(PM57950)”과 “남서태평양 및 인도양 해양광물자원(PM58080)”의 도움으로 수행 되었습니다.
Reference
-
Almgren, T., Dyrssen, D., and Strandberg, M., (1975), “Determination of pH on the moles per kg seawater scale (Mw)”, Deep Sea Research and Oceanographic Abstracts, Elsevier, p635-646.
[https://doi.org/10.1016/0011-7471(75)90051-0]

-
Anderson, D.H., and Robinson, R.J., (1946), “Rapid electrometric determination of alkalinity of sea water using glass electrode”, Industrial & Engineering Chemistry Analytical Edition, 18(12), p767-769.
[https://doi.org/10.1021/i560160a011]

- Bala, G., (2013), “Digesting 400 ppm for global mean CO2 concentration”, Current science, 104(11), p1471-1472.
- Davies, C.W., (1962), Ion association, Butterworths, London.
-
Dickson, A., (1981), “An exact definition of total alkalinity and a procedure for the estimation of alkalinity and total inorganic carbon from titration data”, Deep Sea Research Part A. Oceanographic Research Papers, 28(6), p609-623.
[https://doi.org/10.1016/0198-0149(81)90121-7]

-
Feely, R.A., Sabine, C.L., Lee, K., Berelson, W., Kleypas, J., Fabry, V.J., and Millero, F.J., (2004), “Impact of anthropogenic CO2 on the CaCO3 system in the oceans”, Science, 305(5682), p362-366.
[https://doi.org/10.1126/science.1097329]

-
Feely, R.A., Sabine, C.L., Lee, K., Millero, F.J., Lamb, M.F., Greeley, D., Bullister, J.L., Key, R.M., Peng, T.-H., Kozyr, A., Ono, T., Wong, C.S., (2002), “In situ calcium carbonate dissolution in the Pacific Ocean”, Global Biogeochemical cycles, 16(4), p1144.
[https://doi.org/10.1029/2002GB001866]

-
Gran, G., (1952), “Determination of the equivalence point in potentiometric titrations. Part II. Analyst”, 77(920), p661-671.
[https://doi.org/10.1039/an9527700661]

-
Granéli, A., and Anfält, T., (1997), “A simple automatic phototitrator for the determination of total carbonate and total alkalinity of sea water”, Analytica Chimica Acta, 91(2), p175-180.
[https://doi.org/10.1016/S0003-2670(01)93658-X]

- Grasshoff, K., Ehrhardt, M., and Kremling, K., (1983), Methods of seawater analysis. Second, revised and extended edition, Verlag Chemie, Weinheim, Germany.
- IPCC, (2005), IPCC Special Report on Carbon Dioxide Capture and Storage, Cambridge University Press, United Kingdom.
-
Kanamori, S., and Ikegami, H., (1982), “Calcium-alkalinity relationship in the North Pacific”, Journal of the Oceanographical Society of Japan, 38(2), p57-62.
[https://doi.org/10.1007/BF02110291]

- Maita, Y., Parsons, T.R., and Lalli, C.M., (1984), A manual of chemical and biological methods for seawater analysis, Pergamon press, United Kingdom.
-
Millero, F.J., Lee, K., and Roche, M., (1998), “Distribution of alkalinity in the surface waters of the major oceans”, Marine Chemistry, 60(1), p111-130.
[https://doi.org/10.1016/S0304-4203(97)00084-4]

-
Monastersky, R., (2013), “Global carbon dioxide levels near worrisome milestone”, Nature, 497(7447), p13-14.
[https://doi.org/10.1038/497013a]

- Moosbrugger, R.E., Wentzel, M.C., Ekama, G.A., and Marais, G.V.R., (1993), “Alkalinity measurement: Part 1-A 4 pH point titration method to determine the carbonate weak acid/base in an aqueous carbonate solution”, WATER SA-PRETORIA, 19, p11-21.
-
Orr, J.C., Fabry, V.J., Aumont, O., Bopp, L., Doney, S.C., Feely, R.A., Gnanadesikan, A., Gruber, N., Ishida, A., and Joos, F., (2005), “Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms”, Nature, 437(7059), p681-686.
[https://doi.org/10.1038/nature04095]

-
Paquay, F.S., Zeebe, R.E., (2013), “Assessing possivle consequences of ocean lining on ocean pH, atmospheric CO2 concentration and associated costs”, International journal of Greenhouse Gas Control, 17, p183-188.
[https://doi.org/10.1016/j.ijggc.2013.05.005]

-
Pauss, A., Roza, A., Ledrut, M., Naveau, H., and Nyns, E., (1990), “Bicarbonate determination in complex acid-base solutions by a back-titration method”, Environmental technology, 11(5), p469-476.
[https://doi.org/10.1080/09593339009384887]

-
Riebesell, U., (2000), “Photosynthesis: Carbon fix for a diatom”, Nature, 407(6807), p959-960.
[https://doi.org/10.1038/35039665]

-
Riebesell, U., Zondervan, I., Rost, B., Tortell, P.D., Zeebe, R.E., and Morel, F.M., (2000), “Reduced calcification of marine plankton in response to increased atmospheric CO2”, Nature, 407(6802), p364-367.
[https://doi.org/10.1038/35030078]

- Stumm, W., and Morgan, J. J., (1995), Aquatic chemistry: chemical equilibria and rates in natural waters, John Wiley & Sons, USA.
- Wurts, W.A., (2002), “Alkalinity and hardness in production ponds”, World Aquaculture, 33(1), p16-17.
-
Yao, W., and Byrne, R.H., (1998), “Simplified seawater alkalinity analysis: Use of linear array spectrometers”, Deep Sea Research Part I: Oceanographic Research Papers, 45(8), p1383-1392.
[https://doi.org/10.1016/S0967-0637(98)00018-1]