해양심층수 미네랄추출물(마그네슘염)의 식품원료 안전성 평가를 위한 ICR 마우스를 이용한 소핵시험
초록
본 연구에서는 시험 물질 해양심층수 미네랄 추출물(마그네슘염)의 유전독성을 평가하기 위해 ICR 마우스 골수세포를 이용하여 소핵 유발 여부를 검토했다. 본 시험의 최고 용량을 결정하기 위해 암·수 각 500, 1,000 및 2,000 mg/kg 용량으로 예비시험을 실시한 결과, 암·수 모든 투여 동물에서 일반증상 및 사망 동물이 관찰되지 않았다. 따라서 본 시험은 수컷 동물만 사용하며 2,000 mg/kg을 최고 용량으로 하고 총 3단계 용량(500, 1,000 및 2,000 mg/kg)으로 결정했다. 또한, 음성대조군 및 양성대조군을 추가로 설정했다. 본 시험 결과, 시험 물질 군에서 다염성 적혈구 중 소핵 다염성 적혈구의 출현 빈도(MNPCE/2000PCE)는 500, 1,000 및 2,000 mg/kg 용량에서 각각 0.4, 1.4 및 0.0으로 음성대조군 값 0.4와 비교하여 유의한 증가가 관찰되지 않아서 음성으로 판정되었다. 반면에, 양성대조군에서는 다염성 적혈구 중 소핵 다염성 적혈구의 출현 빈도가 25.6으로 음성대조군 값과 비교하여 유의하게 증가해서 시험 조건을 충족하였다. 총 적혈구 중 다염성 적혈구(PCE/(PCE+NCE))의 출현 빈도는 모든 용량군에서 음성대조군과 비교하여 유의한 증가가 관찰되지 않아서 음성으로 판정되었다. 이상의 결과로부터 본 시험 조건에서 해양심층수 미네랄 추출물 (마그네슘염)은 마우스의 골수세포에서 소핵을 유발하지 않는 것으로 판단된다. 따라서, 해양심층수 미네랄 추출물 (마그네슘염)이 유전독성으로 작용하여 염색체를 손상하거나 세포분열장치에 이상을 유발하지 않는 것으로 평가할 수 있다. 해양심층수 추출 미네랄의 안전한 이용을 위해서 식품의약품안전처의 기준에 따른 소핵시험을 통해 유전 독성시험을 진행하여 해양심층수 미네랄의 안전성을 검증하였다. 해양심층수 미네랄 추출물이 “한시적 식품 원료”로 등록 사용이 가능하도록 안전성 검증 자료로 사용되었다. 해양심층수 미네랄 추출물이 현대인에게 부족한 미네랄을 제공해 줄 수 있다. 특히 해양심층수에서 추출한 미네랄은 인체에 부족한 미네랄을 보충할 수 있을 뿐만 아니라 다양한 용도로 사용하여, 현대인에게 양질의 미네랄을 제공할 수 있다.
Abstract
In this study, to evaluate the genotoxicity of deep seawater mineral extract (magnesium salt), we investigated whether micronucleus is induced using bone marrow cells of ICR mice. In order to determine the highest dose of this test, preliminary tests were conducted at 500, 1,000, and 2,000 mg/kg doses, respectively. As a result, no general symptoms or dead animals were observed in all animals administered with male and female. Therefore, this test uses only male animals, and the maximum dose is 2,000 mg / kg, and the total three-stage doses (500, 1,000, and 2,000 mg/kg) are determined. In addition, a negative control group and a positive control group were additionally set. As a result of this test, there was no significant increase in the incidence of micronucleated polychromatic erythrocytes(MNPCE/2000PCE) 0.4, 1.4, and 0.0 at 500, 1,000, and 2,000 mg/kg doses, respectively, compared to the negative control group value of 0.4. On the other hand, in the positive control group, the incidence of micronucleated polychromatic erythrocytes among the polychromatic erythrocytes increased significantly compared to the negative control group. Among the total red blood cells in the negative control group and the low-dose, medium-dose, and high-dose test substance groups, the average (PCE/(PCE+NEC) of the frequency of appearance of polychloric red blood cells was 0.457±0.056, 0.461±0.053, 0.393±0.052, and 0.399±0.05, respectively, and the positive control group was 0.447±0.07. Therefore, no significant difference was observed in all dosage groups compared to the negative control group. From the above results, it is determined that the deep seawater mineral extract (magnesium salt) does not induce micronucleus in the bone marrow cells of mice under the conditions of the present test. Therefore, it can be evaluated that deep seawater mineral extract (magnesium salt) does not acts as genotoxicity that damages chromosomes or cause abnormalities in cell division devices. For the safe use of deep-sea water extraction minerals, genetic toxicity tests were conducted through micronuclear tests in accordance with the standards of the Ministry of Food and Drug Safety to verify the safety of deep-sea water minerals. Deep ocean water mineral extract was used as safety verification data to enable registration and use as a “temporary food raw material”. Deep ocean water mineral extract can provide the minerals that modern people lack. In particular, minerals extracted from deep ocean water can not only supplement minerals that the human body lacks, but can also be used for various purposes to provide high-quality minerals to modern people.
Keywords:
Micronucleus test, Deep seawater mineral extract, Magnesium salt, Food safety evaluation, Food ingredients of marine resources키워드:
소핵 시험, 해양심층수 미네랄추출물, 마그네슘염, 식품안전성, 해양자원의 식품원료1. 서 론
5대 영양소 중의 하나인 미네랄은 지속적인 경작으로 인한 토양의 미네랄 결핍과 식품의 가공 과정에 일어나는 손실 등으로 인해 현대인들에게 충분히 공급되지 않아 체내 결핍되어 있다(Jack[1998]; Long[1999]). 일례로 미국 농업부(USDA)의 1914년~1992년 채소·과일 미네랄 함량의 연구 결과, 채소와 과일에서 철, 인, 마그네슘, 칼슘과 같은 미네랄 함량이 80년 전과 비교하여 각각 96.09%, 84.51%, 82.70%, 48.15%가 감소했다(USDA[2015]).
현대인의 미네랄 결핍을 해소하는 방법의 하나로 광물성 미네랄들이 사용되고 있지만 흡수하는데 한계가 있어 대체 미네랄 공급원의 개발이 시급한 상황이다. 해양심층수는 마그네슘, 칼슘, 칼륨, 인 등의 풍부한 미네랄을 포함하고 있을 뿐만 아니라 저온성 및 청정한 수질 특성으로 한국, 일본, 대만, 미국 등에서 농수산업, 식품, 에너지 등 여러 분야에 활용되고 있다. 해양심층수 미네랄 추출물이 현대인에게 부족한 미네랄을 제공해 줄 수 있다. 특히 해양심층수에서 추출한 활성미네랄은 인체에 부족한 미네랄을 보충할 수 있을 뿐만 아니라 다양한 용도로 사용하여, 현대인에게 양질의 미네랄을 제공할 수 있다(Moon et al.[2005]).
해양심층수 미네랄의 이용을 활성화하고, 고부가가치를 창출하기 위해서는 과학적인 검증을 통한 안전성 확보가 무엇보다 중요하다. 해양심층수 추출 미네랄의 안전한 이용을 위해서 식품의약품안전처의 기준에 따른 독성시험을 통해 해양심층수 활성미네랄의 안전성을 검증하여, 해양심층수 미네랄 추출물이 “한시적 식품 원료”로 사용이 가능하도록 인증 및 등록 절차가 필요했다(National Institute of Food and Drug Safety Evaluation [2015]).
해양심층수 미네랄 추출물의 제조 공정은 다음과 같다. 해양심층수 원수를 막여과 장치(역삼투막, 전기투석막 등)를 이용하여 탈염수와 농축수로 분리한 후, 농축수를 감압 증발시켜 밀도가 1.3 kg/m3 이상 되도록 농축시켜 미네랄 추출물(마그네슘염)을 칼슘염과 염화나트륨으로부터 분리 추출했다. 분리 건조된 해양심층수 미네랄 추출물의 주요 성분은 염화나트륨 성분이 20% 이하이고 미네랄(마그네슘염) 함량이 60% 이상이었다(Moon et al.[2013]).
해수 또는 해양심층수 기원 미네랄 추출물에 관한 해외 이용 사례로 세계 최초로 해양심층수의 개념을 도입하여 연구를 시작한 미국의 사례와 우리나라와 해양심층수 이용 여건이 유사하며 지리적으로 인접한 일본과 대만의 이용 사례에 대해 살펴보았다. 미국의 경우, 유기농 및 웰빙 용품 전문 판매 매장인 Whole Foods에서 건강보조식품 및 천연물 유래 의·미용용품을 판매하고 있다. 이 매장에서 해수유래 미네랄 및 심층수 배양 미세조류로부터 추출한 의약품, 해수 미네랄을 이용한 미용 제품 등을 판매하고 있다. Whole Food에서는 다양한 미네랄 제품이 판매되고 있으며, 주로 칼슘 제품과 마그네슘 제품이 주종을 이루고 있다. 특히 최근에는 마그네슘의 인체 효용성이 증명되면서 마그네슘 제품의 출시가 증가하고 있으며 분말, 정제 및 액상으로 출시되고 있다. 미네랄 보충 건강 보조 제품은 인공화합물보다는 천연물 소재 제품의 판매가격이 2배 이상이며, 최근에는 인체 흡수율을 높이기 위하여 무기질 형태의 미네랄 제품보다는 유기산(구연산, 아미노산 등)과 Chelate 화한 제품이 판매되고 있다(Yoo et al.[2007]).
해양심층수의 식품 이용 범위 확대가 법제화로 되어 이를 이용한 다양한 식품개발이 가능하게 되었다. 미국, 대만과 일본에서는 해양심층수 미네랄 추출물은 건강 보조 식품 분야에서 제품화하여 고부가가치를 창출하고 있다. 국내에서도 해양심층수 미네랄 추출물을 식품에 사용할 수 있도록 하여 해양심층수 시장 활성화에 부응하도록 하는 것이 연구 목표이다.
이에 따라 해수에서 제품화된 미네랄 추출물이 이미 식품으로 널리 사용되고 있는 외국의 사례를 참고로 하여 국내 해양심층수 미네랄 추출물의 식품사용을 위한 안전기준의 적절성 및 타당성에 대해 동물실험을 하고자 한다. 이를 바탕으로 과학적 검토를 통하여 안전성 확보방안을 제시하여 미네랄 추출물의 식품사용 범위 확대를 위한 근거자료를 확보하고자 한다. 본 시험에서는 식품의약품안전처 고시 제2014-67호 “비임상시험관리기준”(Good Laboratory Practice Guideline: GLP)에 따라서, 시험 물질 해양심층수 미네랄 추출물 (마그네슘염)의 생체 내 염색체이상 유발 또는 유사 분열 기구에 대한 이상 유발 여부를 ICR 마우스 골수세포에서의 소핵 유발성을 지표로 하여 유전독성 여부를 평가하고자 했다.
2. 실험 및 재료
2.1 시험재료
본 연구에서 사용한 시험 물질은 2016년 4월 선박해양플랜트연구소의 해수 해수에너지연구센터에서 제조한 고체 분말 형태의 해양심층수 미네랄 추출물(마그네슘염)이다(Table 1). 부형제로는 대한약품공업 주식회사에서 제조한 멸균 주사 용수(Lot No. 27Q0B21)를 사용했다. 용해도 시험 결과, 시험 물질이 멸균 주사 용수에 용해되었으므로 멸균 주사 용수를 부형제로 선택했다. 양성 대조물질은 고시 및 가이드라인에 제시된 것 중 Sigma-Aldrich(U.S.A.)에서 제조한 Mitomycin C(MMC)를 선택했다.
시험 물질은 순도에 대한 보정 없이 중량 그대로를 조제에 사용하였으며, 전자저울(Pag2102, OHAUS, U.S.A.)로 무게를 재 용기에 넣었다. 규정 용량에 맞게 부형제를 넣고, 시험 물질을 녹였다. 조제는 투여 당일 실시했다. 양성 대조물질 MMC는 멸균 주사 용수로 조제 하였으며, 갈색 튜브에 분주하여 deep freezer(DW-86L-338, Haier, China)에 동결보관(-80 ~ -60℃) 하였고, 시험 처리 일에 해동하여 사용했다. 양성 대조물질의 본 시험에 사용한 MMC는 저장용량은 0.1 mg/mL이며, 투여 용량은 1 mg/kg이었다.
2.2 해양심층수 미네랄 추출물 마우스 소핵 시험 방법
시험에 사용된 마우스는 ㈜오리엔트바이오(경기도 성남시 중원구 갈마치로 322)에서 생산 및 공급하는 특정 병원체가 부재(SPF)한 CrljOri:CD1 (ICR) 마우스를 사용했다. 그 이유는 ICR(Institute of Cancer research) 마우스 소핵시험이 한국 식품의약안전처의 유전독성 안전성시험 가이드라인에 규정되어 있어 가장 널리 사용되고 있으며(National Institute of Food and Drug Safety Evaluation, 2015), 비교할 기초자료가 풍부하기 때문이다. 투여개시 시 체중 범위는 평균 체중의 ±20% 이내였다. ICR 마우스의 성별, 동물 수, 주령 및 체중 범위는 Table 2에 나타냈다. 모든 ICR 마우스를 이용한 동물시험은 한국식품의약품안전처에서 GLP(Good Laboratory Practice, 비임상 시험규정) 인증을 받은 시험업체(크로엔, 대한민국)에서 생명윤리 승인 및 시험법에 따라 진행되었다.
ICR 마우스는 입수 후 5일 이상(예비시험: 7일, 본시험: 6일) 시험을 시행하는 동물 실내에서 순화시키고 모든 동물은 매일 1회 일반증상을 관찰했다. 개체식별은 유성 매직을 이용하여 꼬리에 표시했다(검역 및 순화 시: 붉은색, 군 분리 후: 검은색). 사육상자에는 개체식별 카드를 부착하여 최종검역에서 이상 증상이 없는 동물만 시험에 사용했다. 군 분리 시 측정한 체중으로 군별 평균 체중이 균등하게 되도록 동물을 분배했다. 잔여 동물은 군 분리 종료 후 시험 계로부터 제외했다.
2.3 사육조건
사육환경은 온도 20.14~25.90℃, 상대습도 40.82~53.87%이었으며, 환기횟수는 20회 이상/hr이었다. 사육상자는 폴리카보네이트 사육상자(W200 × L260 × H130 mm)를 이용하였고, 사육밀도는 순화 기간에는 5마리 이하, 시험 기간에는 3~5 마리이었다. 조명주기는 12시간으로 오전 8시 점등하여 오후 8시에 불을 껐다. 조도는 150~300lx이었고, 사육상자 및 급이기는 1회/주, 급수 병은 주당 1회로 교환했다. 시험 기간 중 동물 실의 온도가 시험계획서의 범위(22±3℃)에서 일탈 되었으나 동물의 일반증상에 이상 증상이 발견되지 않아 시험의 결과에 영향을 미치지 않았다.
사료는 방사선 멸균된 실험동물용 쥐 사료는 Chales River Rat and Mouse 18%(5L79, LabDiet, U.S.A.)를 ㈜오리엔트 바이오(경기도 성남시 중원구 갈마치로 322)로부터 공급받아 자유섭취 시켰다. 제조업체로부터 성분 조성표를 받아 확인했다. 실험동물에 공급되는 물은 폴리카보네이트 소재 급수 병(250 mL)에 넣고 자유섭취 시켰다. ㈜신성생명환경연구원(충남 아산시 배방읍 호서로 79번길 20 호서대학교 벤처 창조융합관 208호)에 의해 정기적 검사(1회/년)를 통해 “먹는물수질기준 및 검사 등에 관한 규칙(환경부령 제621호 2015 년 11월 23일 일부개정)”에 적합한지 확인했다.
2.4 투여
음성대조군 및 시험 물질 군은 임상 예정 경로인 경구투여를 선택하고, 양성대조군은 일반적으로 사용하는 복강 내 투여를 선택했다. 음성대조군 및 시험물질군은 경구투여용 존데(Zonde)를 부착한 일회용 주사기를 이용하여 위 내에 강제 투여하며, 양성대조군은 1.0mL(26G)의 주사침을 이용하여 복강 내 투여했다. 투여액의 양은 10 mL/kg로 하고, 개체별 투여량은 투여 당일 체중을 기준으로 산출했다. 음성대조군 및 시험 물질 군은 1회/일, 2일간 투여하며, 양성대조군은 골수채취 24시간 전에 1회 투여했다.
2.5 예비시험
시험 물질 투여 용량은 2,000 mg/kg을 최고 용량으로 하며, 총 3 용량군(500, 1,000 및 2,000mg/kg)으로 설정했다. 저용량, 중용량, 고용량 군당 암·수 각각 3마리로 했다(Table 3).
모든 동물은 투여 기간 최소 하루 2회 일반증상 및 사망 유·무를 관찰했다. 예비시험은 투여 후 2일간 일반증상을 관찰했으며, 체중은 투여 전에 측정했다. 예비시험 결과, 암·수 모든 투여 동물에서 일반증상 및 사망 동물이 관찰되지 않았다. 따라서 본시험은 수컷의 동물만 사용하며 2,000 mg/kg을 최고 용량으로 하고 총 3 단계 용량(500, 1,000 및 2,000 mg/kg)으로 결정했다. 본 시험은 음성대조군(0mg/kg) 및 양성대조군(MMC)을 추가로 설정했고 음성대조군은 부형제를 사용했다.
2.6 본 시험
본 시험은 Table 4 같이 구성하고 모든 동물은 투여 기간 최소 하루 2회 일반증상 및 사망 유·무를 관찰했다. 최종 투여 후 1일간 일반증상을 관찰하며 이환율과 사망률을 조사했다. 체중은 투여 전과 골수세포 채취 전에 측정했다.
모든 동물은 골수세포 채취 직전에 CO2로 안락사시킨 후, 대퇴골을 적출하고 가위를 이용하여 양 끝단을 제거했다. 약 0.5 mL의 우태 혈청 (Fetal bovine serum, FBS)을 적출한 대퇴골의 끝단에 관류시켜 골수세포를 채취했다. 골수세포 부유액은 1,000 rpm에서 5분간 원심 분리한 후 상층액은 버리고 침전된 골수세포를 잘 혼합했다. 깨끗하게 건조된 슬라이드 위에 골수 현탁액을 떨어뜨려 고르게 도말했다. 개체당 2매의 슬라이드를 제작하여, 슬라이드를 공기 중에 충분히 건조 시킨 후, 5분간 메탄올로 고정했다. 고정된 검체는 5% Giemsa 염색액으로 약 20분간 염색하여, buffer(GURR buffer, pH 6.8) 액과 0.004% citric acid를 이용하여 세척한 후 공기 중에 충분히 건조 시켜 커버글라스를 이용하여 봉입시켰다.
검체 중 1매는 코드화하고 1,000배 배율의 현미경으로 관찰했다. 다염성 적혈구가 2,000개가 되도록 계수하여 다염성 적혈구 중 소핵을 가지고 있는 MNPCE(Micro Nucleated Poly Chromatic Erythrocyte)비(MNPCE/2,000 PCE)를 구했다. 개체 당 다염성 적혈구(PCE, Poly Chromatic Erythrocyte)와 정염성 적혈구(NCE, Normo Chromatic Erythrocyte)의 합이 200개가 되도록 계수하여 총 적혈구 중 다염성 적혈구의 비[PCE/(PCE+NCE)]를 구했다.
본 시험은 음성대조군 및 양성대조군의 소핵을 가진 다염성 적혈구 수가 Table 5와 Table 6에서와 같이 historical control data의 범위 내에 있고, 양성대조군이 음성대조군에 비해 통계학적으로 유의하게 증가하는 것을 시험 성립 조건으로 했다. 시험 물질의 결과 판정 기준은 시험 물질 군의 1개 이상 용량 단계에서 MNPCE의 비율이 음성대조군과 비교했을 때 통계적으로 유의성 있게 증가할 경우와 시험 물질 군의 MNPCE 비율이 용량 의존적으로 증가하면 양성으로 판정했다.
다염성 적혈구가 2,000개가 되도록 계수하여 다염성 적혈구 중 소핵을 가지고 있는 MNPCE(Micro Nucleated Poly Chromatic Erythrocyte) 비(MNPCE/2,000 PCE)의 값으로 환산한 historical control value 범위는 음성대조군의 경우 최소 0.2에서 최대 5.2이었고, 양성대조군의 경우 최소 21.8에서 최대 80이었다(Table 5).
통계분석에는 SPSS(PASW statistics 18.0) 프로그램을 사용하여 통계처리 했다. 소핵의 유발 빈도는 Fisher’s exact test로 검증했으며(유의수준: 0.05), 다염성 적혈구의 출현 빈도와 체중은 ANOVA test를 실시하여 통계적으로 유의성을 검증했다(유의수준: 0.05).
3. 결과 및 고찰
3.1 소핵 다염성 적혈구의 출현 빈도 예비 독성시험
해양심층수 미네랄 추출물의 시험 최고 용량을 결정하기 위해 예비 독성시험을 실시했다. 예비시험은 해양심층수 미네랄 추출물(마그네슘염)을 각 500, 1,000 및 2,000 mg/kg 용량으로 각 수컷 3마리씩에 경구투여하였고, 암컷에 대해서도 동일하게 실시했다. 그 결과, 암·수 모든 투여 동물에서 일반증상 및 사망한 동물이 관찰되지 않았다.
따라서 본시험에서는 수컷 동물만 사용하며 2,000 mg/kg을 최고 용량으로 하여 총 3단계 저용량 군(500 mg/kg), 중용량 군(1,000 mg/kg) 및 고용량 군(2,000mg/kg)으로 나누어 소핵 다염성 적혈구의 출현 빈도 시험을 시행했다. 또한, 음성대조군 및 양성대조군을 추가로 설정했다.
3.2 소핵 다염성 적혈구의 출현 빈도
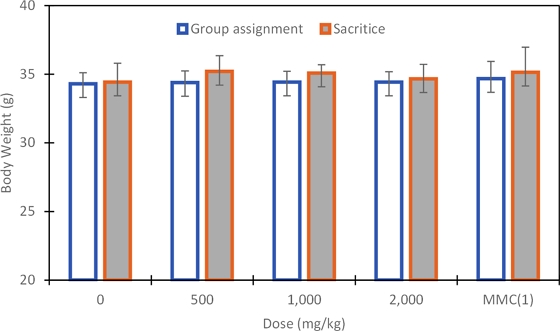
본 시험 결과, Table 7에서와 같이 해양심층수 미네랄 추출물(마그네슘염)을 500, 1,000 및 2,000 mg/kg 투여한 모든 용량군에서 이상 증상 및 사망 동물은 관찰되지 않았고, 이환율 및 사망률은 확인되지 않았다. 또한 각 군 간의 체중을 비교한 결과, 모든 투여군에서 통계적으로 유의한 체중증가가 관찰되지 않았다(Fig. 1).
소핵 다염성 적혈구(MNPCE/2000PCE) 및 다염성 적혈구(PCE/(PCE+NCE))의 출현 빈도를 Table 8에 나타냈다. 음성대조군과 시험 물질 군 500, 1,000 및 2,000mg/kg 용량에서 다염성 적혈구 중 소핵 다염성 적혈구 출현 빈도(MNPCE/2000PCE)의 평균은 각각 0.4, 0.4, 1.4 및 0.0으로, 음성대조군과 비교하여 유의한 차이가 관찰되지 않았다(Fig. 2). 그러나 양성대조군의 소핵 다염성 적혈구의 출현 빈도는 25.6으로 음성대조군과 비교하여 유의한 차이가 관찰되었다(p<0.05).
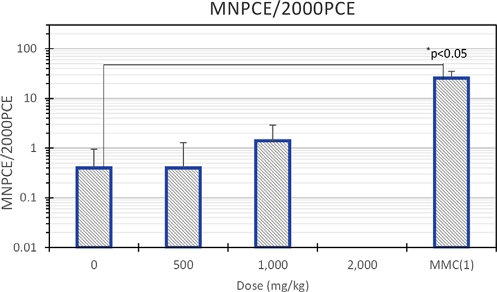
Average frequency of appearance of Micro nucleated poly chromatic erythrocyte (MNPCE) among Poly Chromatic Erythrocyte (2000PCE) in negative (dose 0), positive control (MMC) and dosage groups (500, 1,000, 2,000) of deep seawater mineral extract.
해양심층수 미네랄 추출물에 대한 소핵 다염성 적혈구 출현 빈도 실험 결과, 음성대조군 및 양성대조군의 소핵 다염성 적혈구의 출현 빈도(MNPCE/2000PCE)는 historical control data 범위(음성대조군: 0.2~5.2, 양성대조군: 21.8~80) 내에 있었기 때문에(Table 5), 해당 시험은 적절한 조건에서 실시된 것으로 판단된다.
음성대조군과 저용량, 중용량, 고용량 시험 물질 군의 총 적혈구 중 다염성 적혈구 출현 빈도의 평균(PCE/(PCE+NEC))은 각각 0.457±0.056, 0.461±0.053, 0.393±0.052 및 0.399±0.025로 관찰되었고, 양성대조군은 0.447±0.07로 관찰되어(Table 8) 모든 투여군에서 음성대조군과 비교하여 유의한 차이가 관찰되지 않았다(Fig. 3). 또한 음성대조군, 양성대조군 및 용량별 시험 물질 군의 PCE/(PCE+NCE) 값은 historical control data 범위(음성대조군: 0.42~0.73, 양성대조군: 0.413~0.65) 내에 있었기 때문에(Table 6), 해당 시험은 적절한 조건에서 실시된 것으로 판단된다.
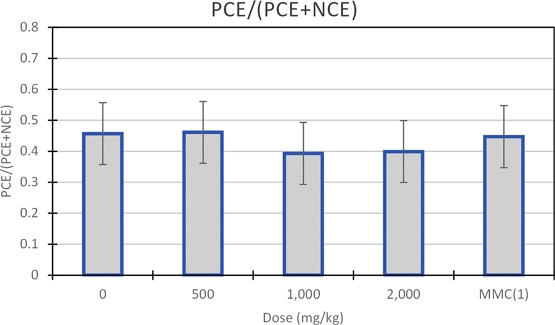
Frequency of appearance of Poly Chromatic Erythrocyte (PCE) among total Chromatic Erythrocyte (PCE+NCE) in negative control and low, medium, and high dosage groups of deep seawater mineral extract.
본 시험에서 음성대조군 및 양성대조군의 소핵을 가진 다염성 적혈구 수(MNPCE/2000PCE)와 총 적혈구 중 다염성 적혈구 출현 빈도(PCE/(PCE+NCE))는 historical control data의 범위 내에 있기(Table 5, Table 6) 때문에 시험 조건을 충족한 것으로 판단되었다. 양성대조군에서 소핵을 가진 다염성 적혈구 비(MNPCE/2000PCE)값이 음성대조군에 비해 통계학적으로 유의하게 증가했기 때문에 시험 조건을 만족한 것으로 판단했다.
해양심층수 미네랄 추출물의 시험 물질 군 500, 1,000 및 2,000 mg/kg 용량에서 다염성 적혈구 중 소핵 다염성 적혈구 출현 빈도의 평균(MNPCE/2000PCE)은 각각 0.4, 1.4 및 0.0으로, 음성대조군 0.4과 비교하여 유의한 차이가 관찰되지 않았고, 시험 물질군의(MNPCE/2000PCE)가 용량 의존적으로 증가하지 않아, 해양심층수 미네랄 추출물은 ICR 마우스를 이용한 소핵시험에서 음성으로 판정되었다. 따라서 본 시험 조건에서 해양심층수 미네랄 추출물(마그네슘염)은 마우스의 골수세포에서 소핵을 유발하지 않는 것으로 판단된다.
4. 결 론
소핵시험 시험 대상 물질인 해양심층수 미네랄 추출물(마그네슘염)의 유전독성을 평가하기 위해 ICR 마우스 골수세포를 이용하여 소핵 유발 여부를 검토했다. 유전독성 판정을 위해서는 동물을 사용하는 in vivo 시험을 반드시 수행해야 한다. 현재 가장 널리 수행되는 in vivo 시험법은 소핵시험으로 소핵을 가진 다염성 적혈구가 증가한다면 해양심층수 미네랄 추출물(마그네슘염)이 염색체를 손상했거나 세포분열장치에 이상을 유발한 것으로 평가할 수 있게 된다. 본 연구에서는 ICR 마우스를 이용하여 골수세포에서의 소핵 시험을 수행하여 해양심층수 미네랄 추출물이 염색체 손상을 유발하는지를 시험하였다.
본 시험의 최고 용량을 결정하기 위해 암·수 각각 500, 1,000 및 2,000 mg/kg 용량으로 해양심층수 미네랄 추출물을 시험 물질로 사용하여 예비시험을 실시한 결과, 모든 암·수 투여 동물에서 일반증상 및 사망 동물이 관찰되지 않았다. 따라서, 본시험에서 수컷 동물만 사용하며, 해양심층수 미네랄 추출물의 최고 투여 용량을 2,000 mg/kg로 결정했다. 또한 경구투여 용량군으로 해양심층수 미네랄 추출물을 500 mg/kg을 투여하는 저용량 군, 1,000 mg/kg을 투여하는 중용량 군과 2,000 mg/kg을 투여하는 고용량 군 등 총 3단계 용량군으로 나누어 시험을 진행했다. 또한, 음성대조군 및 양성대조군을 추가로 설정하여 다염성 적혈구 중 소핵 다염성 적혈구 출현 빈도(MNPCE/2000PCE)의 비율을 비교함으로써, 해양심층수 미네랄 추출물 투여가 ICR 마우스 골수세포에서 소핵의 출현을 유발하는지에 대한 여부를 판정했다.
본 시험 결과, 해양심층수 미네랄 추출물 투여군에서 다염성 적혈구 중 소핵 다염성 적혈구의 출현 빈도(MNPCE/2000PCE)는 음성대조군과 비교하여 유의한 증가가 관찰되지 않았다. 반면에, 양성대조군에서는 다염성 적혈구 중 소핵 다염성 적혈구의 출현 빈도가 음성대조군과 비교하여 유의하게 증가했다. 또한 총 적혈구 중 다염성 적혈구의 출현 빈도(PCE/(PCE+NEC))는 모든 용량군에서 음성대조군과 비교하여 유의한 증가가 관찰되지 않았다.
본 시험에서 음성대조군 및 양성대조군의 소핵을 가진 다염성 적혈구 수(MNPCE/2000PCE)와 총 적혈구 중 다염성 적혈구 출현 빈도(PCE/(PCE+NCE))는 historical control data의 범위 내에 있어서 시험 조건을 충족했다. 또한, 양성대조군에서 소핵을 가진 다염성 적혈구 비(MNPCE/2000PCE) 값이 음성대조군에 비해 통계학적으로 유의하게 증가했기 때문에 시험 조건을 만족한 것으로 판단했다.
해양심층수 미네랄 추출물의 시험 물질 군 500, 1,000 및 2,000mg/kg 용량에서 다염성 적혈구 중 소핵 다염성 적혈구 출현 빈도의 평균(MNPCE/2000PCE)은 음성대조군과 비교하여 유의한 차이가 관찰되지 않고, 용량 의존적으로 증가하지 않아서, 해양심층수 미네랄 추출물은 ICR 마우스를 이용한 소핵시험에서 음성으로 판정되었다. 이상의 결과로부터 본 시험 조건에서 해양심층수 미네랄 추출물(마그네슘염)은 ICR마우스의 골수세포에서 소핵을 유발하지 않는 것으로 판단했다. 따라서 해양심층수 미네랄 추출물 (마그네슘염)이 유전독성으로 작용하여 염색체를 손상하거나 세포분열장치에 이상을 유발하지 않는 것으로 평가할 수 있다.
해양심층수 미네랄 이용을 활성화하고, 고부가가치를 창출하기 위해서는 과학적인 검증을 통한 안전성 확보가 무엇보다 중요하다. 해양심층수 추출 미네랄의 안전한 이용을 위해서 식품의약품안전처의 기준에 따른 소핵시험을 통해 유전 독성시험을 진행하여 해양심층수 미네랄의 안전성을 검증하고, 해양심층수 미네랄 추출물이 “한시적 식품 원료”로 등록 사용이 가능하도록 안전성 검증 자료로 사용했다. 해양심층수 미네랄 추출물이 현대인에게 부족한 미네랄을 제공해 줄 수 있다. 특히 해양심층수에서 추출한 미네랄은 인체에 부족한 미네랄을 보충할 수 있을 뿐만 아니라 다양한 용도로 사용하여, 현대인에게 양질의 미네랄을 제공할 수 있다.
Acknowledgments
본 연구는 해양수산과학기술진흥원의 국가R&D사업인 “해양치유자원 효능/표준화 기술개발 및 해양치유자원의 생애주기 안전관리방안(PMS5620)”에 의해 수행되었습니다.
References
- Jack, A., 1998, Nutrition under siege, One Peaceful World J., 34(1), 7-9.
- Long, C., 1999, Is chemical farming making our food less nutritious? Org. Gard., Vol. 46, No. 6, 12.
-
Makoto Hayashi, James, T., MacGregor, David, G., Gatehouse, David H. Blakey, Stephen D. Dertinger, Lilianne Abramsson-Zetterberg, Gopala Krishna, Takeshi Morita, Antonella Russo, Norihide Asano, Hiroshi Suzuki, Wakako Ohyama, Dave Gibson, 2007, “In vivo erythrocyte micronucleus assay: III. Validation and regulatory acceptance of automated scoring and the use of rat peripheral blood reticulocytes, with discussion of non-hematopoietic target cells and a single dose level limit test”, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 627(1), 10-30.
[https://doi.org/10.1016/j.mrgentox.2006.08.010]

-
Moon, D.S., Kim, H.J., Shin, P.K. and Jung, D.H., 2005, Characteristics of chemical contents of horizontal spray salts from deep ocean water, J. Kor. Fish. Soc., 38(1), 65-29.
[https://doi.org/10.5657/kfas.2005.38.1.065]

-
Moon, D.S., Kim, K.S., Gi, H., Choi, M.Y., Jung, H.J. and Kim, H.J., 2013, The hardness water production by RO/NF/ED linking process from deep seawater, J. Kor. Soc. Mar. Environ. Energy, 16(4), 227-238.
[https://doi.org/10.7846/JKOSMEE.2013.16.4.227]

- National Institute of Food and Drug Safety Evaluation, 2015, Guidelines for Nonclinical Testing of Pharmaceuticals.
- USDA (United States Department of Agriculture), 2015, USDA National Nutrient Database for Standard Reference, Release 28.
-
Yoo, S.H., Kim, H.J., Moon, D.S., 2007, Demand Analysis on the Deep Sea Water Products, Ocean Policy Research, 22(1), 35-65.
[https://doi.org/10.35372/kmiopr.2007.22.1.002]