선체부착생물 수중청소 배출수 내 부착조류 생사판별을 위한 ATP assay 방법 개발
 ; Kyoungsoon Shin2
; Kyoungsoon Shin2 ; Min-Chul Jang2
; Min-Chul Jang2 ; Pung-Guk Jang2
; Pung-Guk Jang2 ; Keun-Hyung Choi3
; Keun-Hyung Choi3 ; Bonggil Hyun2, †
; Bonggil Hyun2, †
초록
선체 수중청소 과정에서 방오도료 부산물과 함께 배출되는 ≥10 and <50 μm 크기 부착조류의 생사판별을 위해서, 세포의 개체수 및 크기에 따라 발광 세기를 정량화하는 ATP assay 방법 적용 가능성에 대해 확인해 보고자 하였다. 선체부착생물 수중청소 배출수 시료는 직접 한국해양과학기술원 연구선과 컨테이너 선박 수중 청소를 통해 획득하였으며, 실험 전 <5 μm mesh를 이용해서 크기가 큰 부유물질을 제거한 다음 모두 멸균 처리하였다. 녹조류인 Tetraselmis suecica와 부착규조류 Navicula sp., Halamphora coffeaeformis, Halamphora veneta 3종을 실험종으로 선정하였으며, 실험구의 개채수 농도 구배는 T. suecica는 0, 5, 10, 25, 50 cells mL-1, Navicula sp., Halamphora coffeaeformis, Halamphora veneta는 0, 50, 100, 500, 1,000 cells mL-1가 되도록 각각 연구선과 컨테이너 선박 수중 청소 배출수 시료에 주입하였다. 개체수 농도 구배에 따른 생물발광(Bioluminescence, RLU) 값과 FDA+CMFDA 염색 결과, 그리고 세포 부피 분석 결과를 비교해서 세포 크기에 따른 RLU 값을 산정하였다. 또한, 수중청소 배출수 부산물에 대한 발광 간섭효과를 확인하기 위해 3종의 부착 규조류들을 선체부착생물 수중청소 전 선박 주변수에 주입하여 RLU 값을 측정하였다. 수중 청소 배출수 조건에서 T. suecia 및 부착 조류 3종의 RLU 값은 생물농도에 따라 선형성을 보였지만(R2=0.942~0.999, p<0.05), 수중청소 배출수 부산물은 Luciferase 효소의 발광 강도에 영향을 미치는 것으로 확인되었다(pooled variance t-test, p<0.05). 본 연구는 선체부착조류의 작은 크기와 응집으로 인한 형광현미경을 활용한 염색 방법의 적용 한계에 따른 대안 연구로 진행되었다. 본 연구에서 선체부착 수중청소 부산물 시료의 간섭효과는 확인되었지만, 생물 밀도에 따른 선형성도 또한 확인되어 향후 추가적인 보완 연구가 진행된다면 선체부착생물 수중청소 ≥10 and <50 μm 크기 부착조류의 생사판별 방법으로 적용 가능할 것으로 판단된다.
Abstract
This study investigated the feasibility of applying the ATP assay method to quantify the luminescence (RLU) intensity based on cell density and size for the live/dead determination of attached microalgae (≥10 and <50 μm) discharged with antifouling biocide particles during the in-water cleaning process. Wastewater samples were obtained from an R/V and container vessel through the in-water cleaning process. Before the experiments, larger particulate debris was removed using a <5 μm mesh before being sterilized. Tetraselmis suecica and the attached diatoms Navicula sp., Halamphora coffeaeformis, and Halamphora veneta were selected as test species. T suecica was inoculated into the wastewater sampled from the R/V vessel at final concentrations of 0, 5, 10, 25, and 50 cells mL-1, while the diatom species were inoculated into the wastewater at final concentrations of 0, 50, 100, 500, and 1,000 cells mL-1. The RLU values, FDA+CMFDA staining, and cell volume analysis results were compared to determine RLU values based on cell size. Additionally, to understand the interference effect of in-water cleaning wastewater on RLU values, the diatom species were inoculated into the ambient water of the container vessel, and RLU values were measured. The RLU values of T. suecica and the diatom species exposed to the in-water cleaning wastewater showed a linear relationship with cell density gradient (R2=0.942-0.999, p<0.05). However, the wastewater was also seen to affect the luciferase reaction rate and RLU intensity (pooled variance t-test, p<0.05). This study is being conducted as alternative research because the fluorescence microscopy staining method is limited by the small size and aggregation of attached diatoms to the vessel’s hull. Our study results suggest that the ATP assay method can be applied to future research on the live/dead determination of attached diatoms in the inwater cleaning wastewater.
Keywords:
ATP assay, Attached microalgae, In-water cleaning, Live/Dead determination키워드:
ATP 측정법, 부착조류, 수중청소, 생사판별1. 서 론
선체부착생물오손은 크기가 작은 박테리아 또는 미세조류부터 상대적으로 크기가 큰 갑각류 동물까지 해수면에 잠긴 선체 부위에 생물이 부착한 것을 의미한다. 이 부착생물들은 선박의 운행 속도를 최대 40%까지 감소시킬 뿐만 아니라 선체의 수명 또한 감소시킨다(Yebra et al.[2004]). 2021년도 기준 약 18만 척에 달하는 국제선박이 국내 항만으로 유입되고 있으며(MOF[2023]), 이들 중 상당수의 선박이 유지 또는 관리 차원에서 선체 수중청소를 진행한 것으로 추측된다. 현재 우리나라를 포함한 몇몇 국가에서 수중청소를 더욱 효율적으로 수행할 수 있는 선체부착생물 수중청소로봇 개발이 진행되고 있다(Hyun et al.[2018a]). 그러나 선체 수중청소 시 발생하는 배출수의 항만 유입은 항만 및 주변 해역의 생태계 교란 및 생물다양성 감소로 이어질 수 있다(Chan et al.[2015]). 이에 국제해사기구(International Maritime Organization, IMO)의 해양환경보호위원회(Marine Environment Protection Committee, MEPC)는 2011년 ‘선체부착생물에 의한 외래위해종 이동 저감을 위한 관리 및 제어 가이드라인’을 채택하였다(MEPC[2011]). 이는 2004년에 채택되고 2019년 발효가 된 IMO의 ‘선박평형수 및 퇴적물의 통제와 관리를 위한 국제 협약(IMO[2004])’과 같이 향후 선체부착 수중청소 생물의 배출 국제 협약으로 발전될 것으로 예측된다.
선체부착생물 수중 청소 배출물 내 생존 생물의 존재 여부는 외래종의 국가 간 이동 방지 차원에서 매우 중요하다 할 수 있다. 그래서 선박평형수 관리협약에서도 ≥10 and <50 μm 크기 생물을 대상으로 적용 가능한 생사판별 방법을 제시하고 있다. 대표적인 방법으로는 Flow cytometry와 FlowCAM(flow-based imaging cytometry)을 이용한 flowtype 자동 입자 계수 방법(Baek and Shin[2009]; Veldhuis and Fuhr[2008])과 Calcein-AM (calcein acetoxymethyl ester) (Baek and Shin[2009]; Peperzak and Brussaard[2011]), FDA(fluorescein diacetate assay) (Garvey et al.[2007]), CMFDA(5-chloromethyl-fluorescein diacetate) (Steinberg et al.[2011]), SYTOX Green nucleic acid stain(Steinberg et al.[2011]) 등이 있다. 하지만 해당 방법들은 부유성 플랑크톤을 대상으로 개발된 방법으로 선박 선체에 부착되어 생물막을 형성하는 작은 크기의 부착규조류의 생사판별 방법으로의 적절성 유무는 확인이 필요한 실정이다.
ATP assay 방법은 Luciferase 효소가 생물 내 ATP와 화학 반응을 통해 빛을 생성하는 Luciferin을 형성하고 ATP 농도 및 발광 세기에 따라 정량화하는 방법으로, 선박평형수처리장치를 통과한 시료 내 모든 크기의 생물그룹 처리효율 확인을 위한 지표분석 방법으로 사용되고 있다(Hyun et al.[2018b]). 따라서 ATP assay 방법은 생물 크기 범위가 협약에 의해 규정화된다면, 규정화된 생물 크기 범위 내 생존 생물 개체수에 따른 ATP 농도 범위를 산정할 수 있다. 그러나 선행연구 결과에 따르면 온도와 pH 그리고 선박 선체에 적용된 방오도료 내 화학물질등에 의해 Luciferase 반응이 불활성화될 수가 있다고 보고되고 있다(Auld and Iglese[2018]; Cho[2000]). 특히 Deluca and McElroy[1978]와 O'Sullivan et al.[2023]의 연구에 따르면, 선박 방오도료 내 많이 포함된 아연과 구리는 Luciferase 반응을 억제하여 화학 발광을 현저하게 감소시킨다고 보고하였다. 또한 선박 방오도료는 2008년 국제법상 금지되기 이전에는 유기주석 화합물인 트리부틸주석(TBT, Tributyltin) 사용이 주를 이루었고 2008년 이후에는 구리염(Copper salts)과 부스터 살생물질(Booster biocides)을 포함한 다양한 화학물질들을 사용해 왔다(Kim[2020]; Telegdi et al.[2016]). 따라서 ATP assay 방법을 활용한 선체부착생물 수중청소 배출수 내 ≥10 and <50 μm 크기의 생존 생물 분석 시 함께 배출되는 방오도료로 인한 영향도 고려되어야 하기 때문에 적용 가능한 시험 방법 개발이 필요한 실정이다.
따라서 본 연구는 Tetraselmis suecica를 수중청소 배출물에 노출시킨 후 나타나는 생물발광 반응이 생물농도에 따라 선형회귀방정식에 부합하는지를 확인해 보고자 하였다. 또한 선체 청소배출수와 선박 주변수 매질 바탕시료(matrix blank sample) 조건에서 3종의 부착 규조류 생물발광 결과가 통계적으로 유의미한지를 판단하였다. 최종적으로 측정 대상의 세포 체적에 따른 ATP 농도 추정을 통해 선체 청소배출수에서 부착규조류의 생사판별을 위한 방법으로 ATP assay의 적용 가능성을 검토하고자 하였다.
2. 재료 및 방법
2.1 수중청소 배출수 샘플링
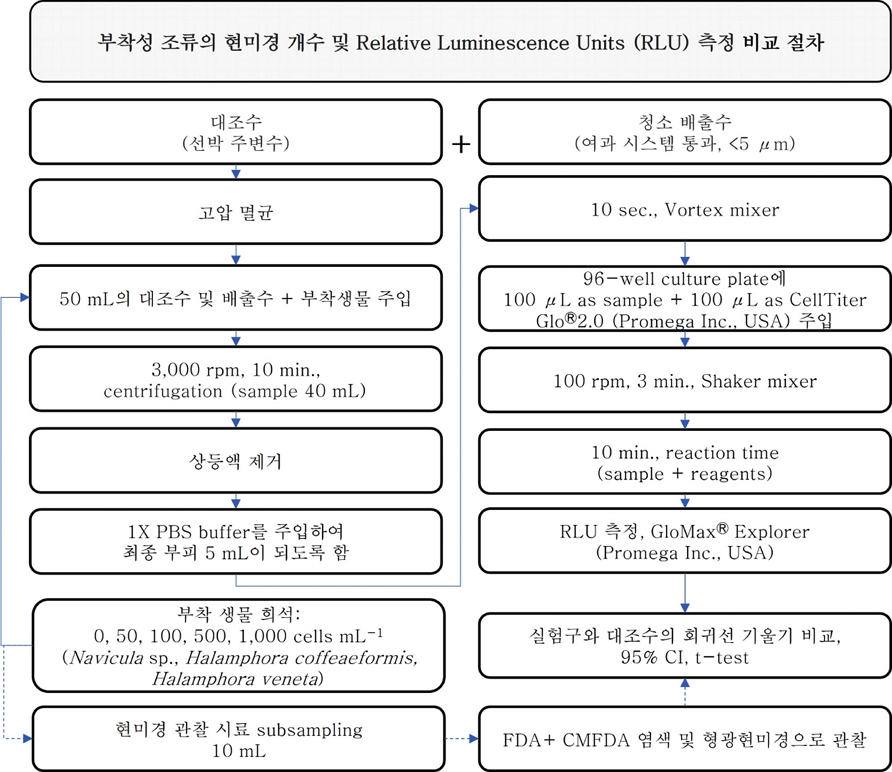
한국해양과학기술원 연구선(2019년 9월 1일)과 컨테이너 화물선(2022년 6월 2일)의 선체의 생물 오손 부위 청소를 통해 배출물 시료를 확보하였다. 수중청소 과정에서 브러쉬 중앙에 있는 내경 1.5 cm 크기의 원형 홀로 유입된 배출물 시료는 격막펌프(Diaphragm pump)를 통해 분당 약 35 L min-1 유속으로 육상의 100 L 플라스틱(Polyethylene) 용기로 이동되었다(Fig. 1). 포집된 배출수 중 10 L를 다시 5 μm nylon mesh 네트로 여과한 다음 4 L 멸균 채수병에 주입 후 실험 전까지 ≤4℃의 암실에서 보관하였다. 또한 컨테이너 화물선의 수중 선체청소 시 수중청소 배출물이 포함되지 않은 주변수도 상기와 같이 5 μm nylon mesh 네트로 여과한 후 4 L 멸균 채수병에 주입하여 대조구로 사용하였다.
2.2 미세조류 선정
미세조류는 기존의 선박평형수 생물사멸평가시험에서 많이 사용되는 단축 기준 크기가 10 μm 내외인 Tetraselmis suecica를 선정하였다(Hyun et al.[2018b]). 부착미세조류는 컨테이너 선박 선체 표면에 생물막을 형성하며 우점 출현하였던 Navicula sp., Halamphora coffeaeformis, Halamphora veneta 3종을 선정하였으며, 각 미세조류는 한국해양과학기술원 해양시료도서관에서 분양받아 실험을 진행하였다.
2.3 실험 방법
T. suecica를 활용한 수중청소 배출물 노출 실험을 위해 배출물 시료는 연구선에서 채집된 시료를 사용하였으며, 생물 주입 전 고압 멸균한 뒤 튜브에 50 mL씩 분주하였다. 그리고 50 mL Conical tube에 최종 생물농도가 0, 5, 10, 25, 50 cells mL-1 가 되도록 조성하였다(Fig. 2). 부착미세조류(Navicula sp., H. coffeaeformis, H. veneta)를 대상으로 진행된 실험에서도 컨테이너 화물선 수중 청소 배출수와 주변수(대조구)를 멸균한 다음 50 mL 튜브에 최종 생물 농도가 0, 50, 100, 500, 1,000 cells mL-1 가 되도록 3종의 부착미세조류를 각각 주입하였다(Fig. 2). 그리고 실험에 사용되는 모든 실험 용기는 멸균하여 오염 가능성을 최소화하였다.
2.4 분석 방법
생물의 성장 및 사멸을 확인하기 위해 FDA/CMFDA 형광염색법을 사용하였고, FDA/CMFDA 시약 조제는 백과 신[2015]의 선행연구에 준해서 진행하였다. FDA/CMFDA 형광 염색을 위해 시료 1 mL 기준 FDA 시약 25 μL를 먼저 주입 후 충분히 교반한 다음 CMFDA 시약 10 μL를 주입하였다. 약 15분간 암상태에서 시료와 염색약을 반응시킨 후 형광현미경(Axioplan II, Carl Zeiss, Germany) blue excitation filter(excitation: 450-490 nm, emission: ≥520 nm) 하에서 염색 유무를 관찰하였다(n=3)(Fig. 2).
생물사멸 평가 대상의 시료(40 mL)가 들어 있는 50 mL Conical tube를 3,000 rpm에서 10분 동안 원심분리 농축하여(Hanil Scientific Inc., Republic of Korea) 상등액을 조심스럽게 제거한 후 1X PBS buffer(Gibco Inc., USA)를 첨가하여 최종 부피가 5 mL이 되도록 하였다. Vortex mixer로 시료와 PBS buffer가 잘 혼합되도록 한 뒤 96-well culture plate(Thermo Fisher Scientific, Denmark)에 농축 시료 100 μL를 주입하고 CellTiter Glo®2.0 (Promega Inc., USA)을 100 μL를 주입하였다. 100 rpm에서 3분간 궤도형 교반기(Hangzhou Allsheng Instruments Co., China)로 시료와 시약이 혼합되게 한 후 10분간 반응 시간을 두었다. 생물발광(Relative Luminescence Units, RLU) 측정은 Luminometer인 GloMax® Explorer (Promega Inc., USA)로 측정하였다(n=5)(Fig. 2).
2.5 미세조류 부피 계산 및 ATP 정량화
미세조류의 부피는 선행연구자료를 참고하여 계산하였고 방법은 Table 1과 같다(Hyun et al.[2018b]; Sun and Liu[2003]; U.S.EPA[2021]). 그리고 미세조류의 부피 계산 시 Table 1의 계산식 c에 해당하는 세포의 두께(height or depth, μm)는 스웨덴과 노르웨이의 Nordic Microalgae(http://nordicmicroalgae.org) 및 Aquatic Protozoa Checklist를 참조하였다. 또한, Hyun at al.[2018b]에서 적용한 ATP 농도 검량선을 참고하여 미세조류 단일 개체가 발현하는 ATP 농도(ATP concentration (pg mL-1) = 0.1571 × RLU value + 814.45)와 미세조류 단일 세포 부피(μm3)당 가지는 ATP 양을 정량화했다(yATP= 59.27 × exp(0.0002×cell volume)+ 870.09).
2.6 통계 분석
형광현미경 계수값과 측정된 RLU의 선형성을 확인하기 위해 단순선형회귀분석(SPSS 25.0, IBM Inc., USA)을 실시하였다. 또한 부착미세조류 시료인 경우 ATP 측정 시 수중 청소부산물 영향 유무를 판단하기 위해 청소배출수와 대조구의 회귀선 기울기 비교를 95% 신뢰수준에서 t-test를 진행하였다. 분석은 Excel 2019 (Microsoft Inc., USA)를 이용하였다. 이때 기울기가 t 분포를 따르고, 두 모집단에 대한 모분산이 같다는 가정(pooled error variance)하에 진행하였다(Fig. 2).
3. 결과 및 고찰
3.1 미세조류의 크기와 형태
미세조류의 단위 체적당 ATP 농도를 산출하기 Table 1에 기반하여 장축과 단축을 측정하였고, 3종의 부착미세조류인 경우 크기가 작고 피침형으로 단축과 두께(Table 1, b and c)의 구별 자체가 어려워 단축과 두께의 길이는 동일하다고 가정하였다. 측정 결과를 보면, 부유성 미세조류인 T. suecica의 크기는 장축 12.0 ± 1.19 μm, 단축 10.6 ± 0.55 μm로 확인되었고, 부착미세조류 Navicula sp., 크기는 장축 6.98 ± 0.39 μm, 단축(두께) 1.91 ± 0.53 μm, H. coffeaeformis의 크기는 장축 16.4 ± 3.03 μm, 단축(두께) 7.89 ± 1.76 μm 그리고 H. veneta의 크기는 장축 7.06 ± 0.01 μm, 단축(두께) 1.91 ± 0.21 μm으로 확인되었다. 측정된 길이를 바탕으로 계산된 미세조류의 부피는 T. suecica는 약 706 μm3, Navicula sp.는 20.0 μm3, H. coffeaeformis는 510 μm3 그리고 H. veneta는 12.9 μm3로 확인되었다(Hyun et al.[2018b]). 그리고 세포 형태는 미세조류 4종 모두 단일 세포 형태를 보이지만, 개체수 농도가 증가함에 따라 부착미세조류 3종의 경우 개체 간 응집(aggregation)이 발생하였다(Table 2).
3.2 Tetraselmis suecica 개체수 및 RLU 분석 결과
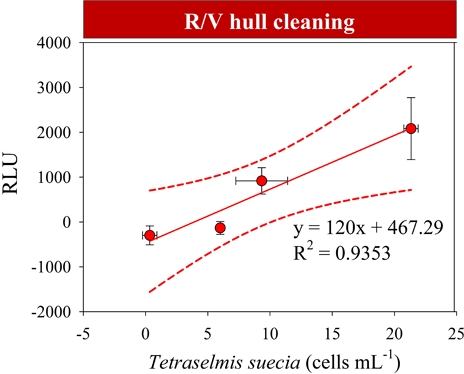
수중 선체 청소배출수에서 T. suecica 생물농도 증가에 대한 RLU 증가는 F=28.908 (p<0.05), 상관계수 R2은 0.935, RLU 값의 β는 0.008 (p<0.05)이고, 표준화 계수(β)가 정(+)적이므로 RLU 증가는 T. suecia 유의미한 개체수 증가를 의미한다(Table 3, Fig. 3). 따라서, 청소배출수 조건에서 살아 있는 T. suecia를 ATP로 정량화가 가능하다고 판단되어 Hyun et al.[2018b]의 선행연구 결과에서 표준물질을 이용하여 측정된 RLU 값을 ATP로 산출하는 수식을 적용해 보면, T. suecica는 1 cell 당 약 907 pg mL-1이고, cell volume (μm3) 당 938 pg mL-1로 갖는 것으로 계산되었다(Fig. 5).

Results of simple linear regression analysis between bioluminescence (RLU) and Tetraselmis suecia (cells mL-1)
3.3 Navicula sp., Halamphora coffeaeformis, Halamphora veneta 개체수 및 RLU 분석 결과
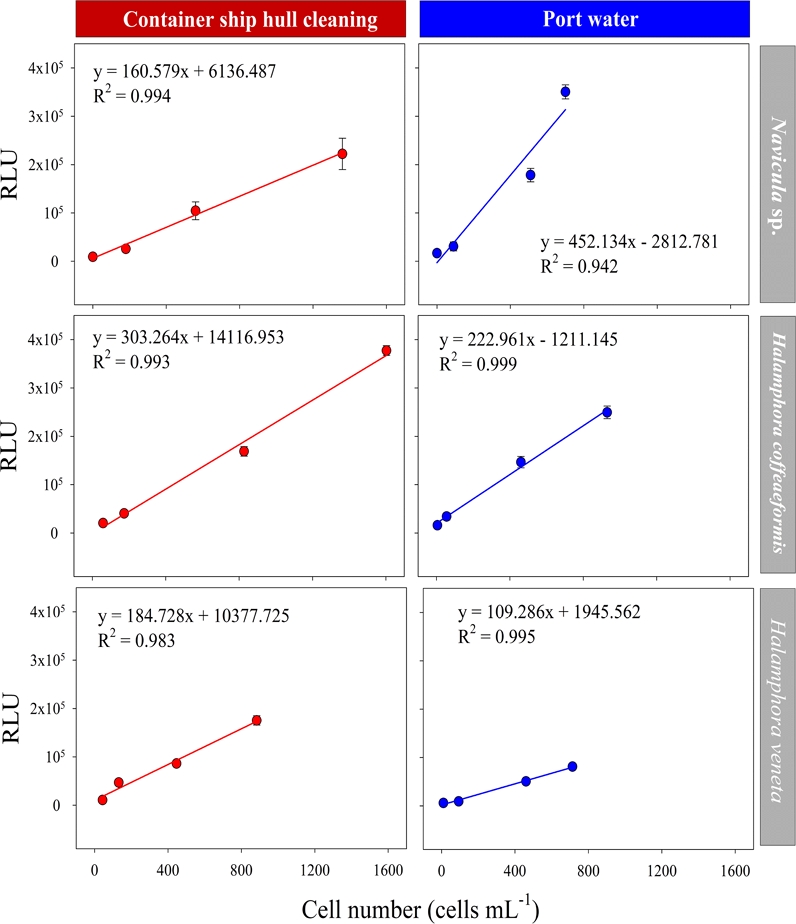
수중청소 배출수와 대조수 내 미세조류 생물농도에 따라 발현된 생물발광(RLU) 값이 회귀모형에 적합한지 판단하고 매질 바탕 시료에 따라 계산된 ATP 농도 결과를 비교해 보았다. 결과를 보면, Navicula sp.는 수중청소 배출수 시료에서 F=326.1, p<0.01로 확인되었고, 대조수에서도 F=32.51, p<0.05로 매질 바탕 시료에 상관없이 회귀모형에 부합하는 것으로 확인되었다. H. coffeaeformis와 H. veneta도 매질 바탕시료에 상관없이 수중청소 배출수(H. coffeaeformis: F=281, p<0.01; H. veneta: F=116, p<0.01)와 대조수(H. coffeaeformis: F=281, p<0.01; H. veneta: F=365, p<0.01) 모두 회귀모형에 부합하는 것으로 확인되었다(Table 4).

Results of simple linear regression analysis between bioluminescence (RLU) and attached Algae; (A) Navicula sp., (B) Halamphora coffeaeformis, (C) Halamphora veneta
ATP 농도 계산을 위해 Fig. 4의 회귀 방정식에 따라 1 cell 당 RLU를 구하고 Hyun et al.[2018b]의 ATP 농도를 산출식을 적용한 결과 Navicula sp.는 청소배출수에서 1,804 pg mL-1 cell-1, 대조수에서 444 pg mL-1 cell-1, H. coffeaeformis는 청소배출수에서 3,080 pg mL-1 cell-1, 대조수에서 659 pg mL-1 cell-1 그리고 H. veneta는 청소배출수에서 2,473 pg mL-1 cell-1, 대조수에서 1,137 pg mL-1 cell-1을 나타내어 대조수 대비 수중청소 배출수 시료에서 상대적으로 1 cell 당 높은 ATP 농도 값을 보였다. 이는 미세조류의 ATP 측정 시 바탕시료에 따라 서로 다른 ATP 농도 값을 나타낼 가능성이 있음을 의미한다. 따라서 바탕시료가 Luciferase 효소 발광에 영향을 미치는지 통계적으로 검토하기 위해 pooled t-test를 기반으로 Fig. 4의 청소배출수 시료와 대조수 두 그룹의 기울기를 비교하였다. 그 결과 Navicula sp., H. coffeaeformis 그리고 H. veneta의 회귀모형의 기울기는 매질 바탕 시료에 따라 유의미한 발광 차이(pooled variance t-test, p<0.05)를 나타내었다(Fig. 4, Table 5). 이러한 바탕시료에 따른 회귀모형의 기울기 차이는 청소부산물 내 부산물이 Luciferase 효소의 발광 반응에 영향을 미친 것으로 판단된다. Luciferase 효소 발광에 대한 금속염의 영향은 이온 농도에 의해 결정되는 것으로 알려져 있다(Rodionova and Petushkov[2006]). Rodionova and Petushkov[2006]의 연구에서 2가 금속염(Mg2+, Mn2+ 및 Ca2+)은 Luciferase 효소의 활성을 증가시켰고 1가 금속염은 음이온에 따라 억제 효과를 나타내었다(Cl- <CO32-, SO32-, Br- <SO4-2, PO4-3, NO3- <I- 등). 따라서 Navicula sp., H. coffeaeformis 그리고 H. veneta는 매질의 수중청소 부산물의 존재, 금속염 종류 및 농도에 따라 서로 다른 발광 결과값을 나타낼 수 있다. 그리고 Luciferase 효소 발광 증가 및 억제는 ATP assay를 이용한 선체부착생물 수중청소 배출수 내 부착조류 생사판별에 방해 요소로 작용할 것으로 판단된다. 이를 보완하기 위해 분석하고자 하는 시료와 동일한 매질에 일정량의 표준물질을 첨가하여 검정곡선을 구하는 표준물질첨가법(Standard addition)을 고려할 필요가 있다고 판단되며, 표준물질을 활용한 선체부착생물 ATP 분석 추가 절차는 다음과 같다(Elison and Thompson[2008]): 첫째, 측정 대상의 시료를 고압멸균하여 매질 바탕시료를 준비한다. 둘째, 50 mL의 매질 바탕시료에 알려진 농도의 ATP 표준물질을 주입한다. 마지막으로, Fig. 2와 같이 농축 및 측정 절차를 걸쳐 검량선을 산출하고 시료의 ATP 농도를 계산한다.
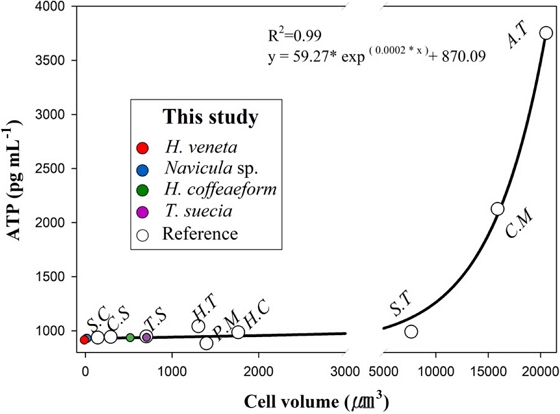
Relationships between the ATP concentration (pg mL-1) and cell volume (μm3) (S.C: Skeletonema costatum, C.S: Chaetoceros simplex, T.S: Tetraselmis suecica, H.T: Heterocapas triquetra, P.M: Prorocentrum minimum, H.C: Heterocapsa circularisquama, S.T: Scrippsiella trochoidea, C.M: Chattonella marina, A.T: Alexandrium tamarense, Hyun et al.[2018b]).

Comparison of regression line slopes between Hull-Clenaing sample and control groups (95% confidence level, pooled variance t-test); (A) Navicula sp., (B) Halamphora coffeaeformis, (C) Halamphora veneta
현재 IMO 선박평형수 협약은 D-2 기준에 따라 평형수를 배출해야 하고 ≥10 and <50 μm 크기 생물은 살아있는 세포 농도가 <10 indiv. mL-1이 되도록 처리하여 배출해야 한다(IMO[2004]). Hyun et al.[2018b]은 살아있는 플랑크톤의 ATP 농도는 세포 부피가 밀접한 상관관계가 있다고 보고 했으며, 선박평형수 배출수 기준 충족 여부를 평가하기 위해 ATP 농도와 세포 부피 비를 이용해 생사판별을 실시하였다. 따라서 이러한 평가 방법을 선체부착물 후처리 장치의 배출수에 적용해 보고자 본 연구에서는 ≥10 and <50 μm 크기에 해당하는 생물인 H. coffeaeformis를 선정하였다(Table 2). H. coffeaeformis의 ATP 농도/세포 부피 비는 Hyun et al.[2018b]의 Fig. 3b 수식을 인용하여 계산하였다. 그 결과, 10개의 살아 있는 H. coffeaeformis 세포가 존재할 때 ATP 농도/세포 부피 비는 2.82 pg mL-1 μm-3로 나타났다. ≥10 and <50 μm 크기 생물의 세포의 최소 부피와 최대 부피를 계산하기 위해 장축의 길이가 10 μm 및 50 μm일 때의 부피를 계산하였다. 이때 실제 현미경 측정 자료(Table 2)의 장축/단축 비를 기반으로 단축과 두께의 길이를 적용하였다. H. coffeaeformis의 장축이 10 μm, 단축과 두께는 4.81 μm로 가정할 때 부피는 115.7 μm3으로 나타났고, H. coffeaeformis의 장축이 50 μm, 단축과 두께는 24.1 μm로 가정할 때 부피는 14,465 μm3으로 나타났다. 따라서 10개의 살아 있는 세포에 대한 ATP 농도의 최소값과 최대값은 각각 326 pg mL-1 (2.82 pg mL-1 μm-3× 115.7 μm3) 및 40,793 pg mL-1(2.82 pg mL-1 μm-3× 14,465 μm3)로 계산된다. 이 농도를 기반으로 D-2 규정에 따른 배출 허용/불가의 ATP 농도 기준은 다음과 같다. <326 pg mL-1 (배출 가능); 326~40,793 pg mL-1(추가 조사 필요함); > 40,793 pg mL-1 (배출 불가).
4. 결 론
본 연구의 결과는 선체 청소배출수에서도 ATP 분석이 생물사멸을 평가할 때 이용 할 수 있는 방법 중 하나임을 보여주었다. 선행연구에서 다루어진 부유생물뿐만 아니라 부착 규조류에서 생물농도와 높은 선형 관계를 나타내었다(R2 range : 0.94-0.99). 그리고 방오도료 입자가 있는 시료의 환경은 ATP 효소 발광 강도에 영향을 미치는 것으로 나타났다. 이는 시료를 고압멸균하여 매질 바탕시료(matrix blank sample)를 준비한 다음 ATP 표준물질을 주입한 후 측정되는 값으로 억제되는 생물발광 강도를 보정 할 수 있을 것으로 판단된다. 따라서 높은 분석 감도를 갖는 ATP assay 방법은 수중 선체 청소배출수 내 부착조류 생사판별 방법으로 적용할 수 있을 것으로 판단된다. 그리고 ATP assay 방법의 향후 개선사항으로 응집된 생물군집을 효과적으로 분리/분별하여 실험 오차를 줄일 수 있는 실험 방법의 개발과 함께 수중 청소용 로봇 배출수 기준에 준하는 낮은 생물농도에서의 실험이 고려되어야 할 것으로 판단된다.
Acknowledgments
본 연구는 2023년도 해양수산부 재원으로 해양수산과학기술진흥원의 지원을 받아 수행하였습니다(연구개발과제번호: RS-2021-0651, 선체부착생물 관리 및 평가 기술개발).
References
- Auld, D.S., and Inglese, J., Interferences with luciferase reporter enzymes. Assay Guidance Manual, https://www.ncbi.nlm.nih.gov/books/NBK374281, , 2018 (accessed 2023.05.08.)
-
Baek, S.H. and Shin, K., 2009, Applicability of Fluorescein Diacetate (FDA) and Calcein-AM to Determine the Viability of Marine Plankton, Ocean Polar Res., 31(4), 349-357.
[https://doi.org/10.4217/OPR.2009.31.4.349]

-
Chan, F.T., MacIsaac J.J. and Bailey S.A., 2015, Relative importance of vessel hull fouling and ballast water as transport vectors of nonindigenous species to the Canadian Arctic, Can. J. Fish. Aquat. Sci., 72(8), 1230-1242.
[https://doi.org/10.1139/cjfas-2014-0473]

- Cho, K.W., 2000, Bioluminescent Assay of Bovine Liver Riboflavin Kinase Using a Bactreial Luciferase Coupled Reaction, J. Microbiol., 38(2), 74-79.
-
Deluca, M. and McElroy, W.D., 1978, Purification and properties of firefly luciferase. In Bioluminescence and Chemiluminescence, Academic Press, 3-15.
[https://doi.org/10.1016/0076-6879(78)57003-1]

-
Elison, S.L.R., Thomposn, M., 2008, Standard additions: myth and reality, The Analyst, 133(8), 992-7.
[https://doi.org/10.1039/b717660k]

-
Garvey, M., Moriceau, B. and Passow, U., 2007, Applicability of the FDA assay to determine the viability of marine phytoplankton under different environmental conditions, Mar. Ecol. Prog. Ser., 352, 17-26.
[https://doi.org/10.3354/meps07134]

-
Hyun, B., Jang., P.G., Shin, K., Kang, J.H. and Jang, M.C., 2018a, Ship’s Hull Fouling Management and In-Water Cleaning Techniques, J. Korean Soc. Mar. Environ. Saf., 24(6), 785-795.
[https://doi.org/10.7837/kosomes.2018.24.6.785]

-
Hyun, B., Cha H.G., Lee, N., Yum, S., S. Baek, H. and Shin, K., 2018b, Development of an ATP assay for rapid onboard testing to detect living microorganisms in ballast water, J. Sea Res., 133, 73-80.
[https://doi.org/10.1016/j.seares.2017.03.003]

- IMO, 2004, International Convention for the Control and Management of Ship’s Ballast Water and Sediment, 2004, International Maritime Organization.
- Kim, H.S., 2020, Study on adhesion properties of Anti-fouling coating by varying the composition of Tie-coat, M.S. Dpet. Appl. Chem. Eng., Pukyong Nat’l. Univ., Busan, Republic of Korea.
- MEPC, 2011, 2011 Guidelines for the Control and Management of Ships' Biofouling to minimize the transfer of invasive Aquatic Species, Marine Environment Protection Committee, Resolution MEPC.207(62).
- MOF, Statistics of Vessels Arriving at Korean Ports by Weight Class, https://www.mof.go.kr/statPortal/cate/statView.do, , 2023 (accessed 2023.05.06.).
-
O'Sullivan, J.J., Lee V.J. and Heffern, M.C., 2023, Copper-mediated oxidation of imidazopyrazinones inhibits marine luciferase activity. Luminescence, 38(2), 216-220.
[https://doi.org/10.1002/bio.4415]

-
Peperzak, L. and Brussaard, C.P., 2011, Flow cytometric applicability of fluorescent vitality probes on phytoplankont 1, J. Phycol., 47(3), 692-702.
[https://doi.org/10.1111/j.1529-8817.2011.00991.x]

-
Steinberg, M.K., Lemieux, E. J. and Drake, L. A., 2011, Determining the viability of marine protists using a combination of vital, fluorescent stains, Mar. Biol., 158, 1431-1437.
[https://doi.org/10.1007/s00227-011-1640-8]

-
Sun, J. and Liu, D., 2003, Geometric models for calculating cell biovolume and surface area for phytoplankton, J. Plankton Res., 25(11), 1331-1346.
[https://doi.org/10.1093/plankt/fbg096]

-
Telegdi, J., Trif, L. and Románszki, L., 2016, Smart anti-biofouling composite coatings for naval applications. Smart Composite Coatings and Membranes, 123-155.
[https://doi.org/10.1016/B978-1-78242-283-9.00005-1]

- U.S.EPA, 2021, Standard Operating Procedure for Phytoplankton Analysis. LG401, Revision 07, March 2021.
- Veldhuis, M.J. W. and Fuhr, F., 2008, Final report of the land-based and shipboard testing of the SEDNAw-system, NIOZ Royal Netherlands Institute for Sea Research, Texel, Netherlands.
-
Yebra, D.M., Kiil, S. and Dam-Johansen, K., 2004, Antifouling technology - past, present and future steps towards efficient and environmentally friendly antifouling coatings, Prog. Org. Coat., 50(2), 75-104.
[https://doi.org/10.1016/j.porgcoat.2003.06.001]